1. TGN1412 사건과 파라셀수스 도그마의 종말
○ 바이오의약품(biologics)인 TGN1412에 대한 임상시험에서의 사고는 기존 독성시험의 개념뿐만 아니라 파라셀수스의 도그마를 무너뜨리며 새로운 독성시험의 접근을 요구하는 계기가 되었다. 반복투여독성시험에서 NOAEL을 통해 합성의약품의 임상초회최대권장용량인 MRSD를 추정하는 대신에 바이오의약품의 임상예정용량 추정을 위해 MABEL(minimum anticipated biological effect level, 생물학적영향-최소추정용량) 개념을 제시하게 되었다, 독일의 테제네로 (TeGenero) 가 개발한 단일클론 항체(monoclonal antibody)인 TGN1412는 백혈병과 만성 염증성 질환의 치료를 위하여 개발된 약품으로 2006년 영국에서 6명의 피험자를 대상으로 안전성을 시험하는 제1상 임상시험이 수행되었다.
○ 임상시험에서 이들에게 투여된 용량은 흰쥐와 개, 원숭이 등으로부터 추정된 NOAEL과 HED(human equivalency)를 이용하여 산출된 MRSD 용량이었다. 동물에게 특이적 독성반응이 없었지만, 인체에서는 전혀 다른 심각한 독성반응이 나타났다. 지원자들은 TGN1412이 투여되고 1주 후 염증이 매우 심해지고 극심한 고통을 겪게 되었다. TGN1412이 투여된 6명 중 2명은 거의 죽음에 이르렀고 1명은 의료기기의 도움으로 연명, 그리고 나머지 3명은 심부전, 간부전, 폐렴, 패혈증 등이 확인되었다.
○ 바 이오의약품은 추출이나 합성을 통해 개발되는 일반적인 약물의 형태인 저분자 화학물질(small molecule)이 아니라 in vitro system을 포함한 생물체에서 생명공학적 기술을 응용하여 개발되는 효소 및 항체 등의 고분자 단백질 또는 세포 치료제이다. 아래의 <그림>에서처럼 합성화학물질의 분자량이 1000 달톤(dalton) 이하이라면 바이오의약품은 약 20000에서 300000 달톤 또는 그 이상 200,000 달톤 정도이다. 이와 같은 치료제의 바이오의약품은 경구투여를 통한 소화계에서 분해를 막기 위해 정맥으로 주입되기 때문에 아주 낮은 용량에서 생물학적 반응 및 약리작용이 시작할 수 있다는 점이다. 특히 바이오의약품의 생물학적 반응을 위한 기전의 구성요소에서 인체와 동물의 차이점과 정맥투여로 빠르고 저용량에 의한 약리작용 시작 등에 대한 고려가 부족한 상태에서 TGN1412의 임상시험 수행으로 인체 치명적인 피해사건이 발생한 것으로 추정된다.
○ 바이오의약품과 합성의약품의 용량-반응곡선에서 차이점: 아래의 <그림>의 A)에서처럼 바이오의약품은 낮은 농도와 높은 농도에서 작용제 (agonist) 와 길항제 (antagonist) 의 상반된 기능이 존재하여 질환 치료에 있어서 용량별 기능의 확인은 중요하다. <그림>의 B)처럼 합성의약품에 대한 전통적인 독성학적 이론인 “All substances are poisons; there is none which is not a poison. The right dose differentiates a poison and a remedy (모든 물질은 독성을 가지고 있다. 단지 약이냐 독이냐 하는 차이는 용량에 의존한다) ” 파라셀수스 이론 (Paracelsus dogma) 이 향후 모든 물질 또는 모든 약물에 적용되기 어렵게 되었다. 그리고 “For decades, Biologics and endocrine-disrupting chemicals( EDC) have challenged this traditional concepts in toxicology, in particular ”the dogma of “the dose makes the poison,” because biologics and EDC can have effects at low doses that are not predicted by effects at higher doses (지난 수 십년 동안 바이오의약품과 내분비계장애물질들은 저용량에서 영향이 확인되고 고용량에서 영향에 대한 예측이 어렵기에 파라셀수스의 도그마를 모든 물질에 적용하기가 어렵다) 와 같은 저용량에서 물질의 효능 및 독성예측에 대한 새로운 학설이 제시되었다. 이는 곧 바이오의약품의 경우에 유효성과 독성시험의 동시 시작할 필요성이 있으며 바이오의약품의 독성시험을 통한 임상시험을 위한 MRSD 산츨에 있어서 새로운 접근 및 개발의 필요성이 제시되었다고 할 수 있다.
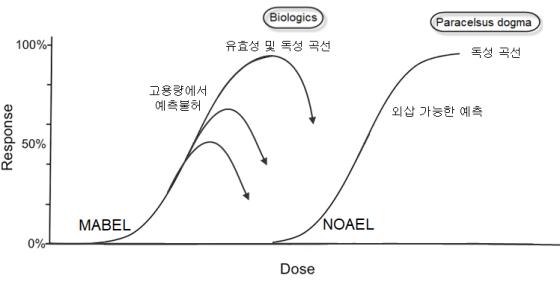
<그림> 바이오의약품과 합성의약품의 용량-반응곡선에서 차이: A)에서처럼 바이오의약품(biologics)은 낮은 농도와 높은 농도에서 작용제(agonist)와 길항제(antagonist)의 상반된 기능이 존재하여 질환 치료에 있어서 용량별 기능의 확인은 중요하다. B)에서처럼 합성의약품에 대한 전통적인 독성학적 이론인 파라셀수스 이론(Paracelsus dogma)인 ’모든 물질은 독성을 가지고 있다. 단지 약이냐 독이냐 하는 차이는 용량에 의존한다”의 이론이 향후 모든 물질 또는 모든 약물에 적용하기 어렵게 되었다.
2. 바이오의약품과 합성의약품의 차이
1) 바이오의약품과 합성의약품의 크기
○ 유럽에서는 첨단치료의약품(Advanced Therapy Medicinal Product, ATMP)이라고 불리는 biologics 또는 biologic drug은 우리나라에서는 공식적으로 생물제제 또는 생물의약품으로 불리고 있다. 그러나 합성의약품(pharmaceutical, synthetic drug)과 대별되고 합성이 아니라 살아있는 미생물, 식물 또는 동물세포를 이용하여 제조된다는 점에서 biopharmaceutical(바이오의약품)으로 불리기도 한다. 따라서 바이오의약품은 생물체를 이용해 복잡한 제조공정을 거치므로 생산 측면에서 주변 환경 변화에 민감하다. 또한 합성의약품과의 분자량 측면에서 1000 MW 이하의 small molecules과 대별되게 바이오의약품은 200 kDa의 biotechnological product wiith large 또는 high MW이다. 예를 들어 <그림>에서처럼 아스피린인 아세틸살리실산(acetylsalicylic acid)은 180 Da에 불과하지만 인슐린(insulin)은 5,800 Da 그리고 단일항체(monoclonal antibody, mAb)는 150,000 Da이다, 따라서 바이오의약품은 수 백개의 아미노산의 연결체이라면 합성의약품은 1-5 정도의 아미노산 크기 정도이다, 따라서 일반적으로 합성의약품에 비해 크기가 크고 복잡한 구조를 가지고 있다.

<그림> 합성의약품과 바이오의약품의 크기 차이와 복제약의 특징
2) 바이오의약품과 합성의약품의 약리작용 및 독성학적 특성
○ 표적 및 비표적 특이성: 생명공학과 분석기술의 발달로 매년 USFDA에 의해 신약으로 허가를 받는 바이오의약품은 10-20개 정도이다. 아래의 <표>에서처럼 합성의약품과 바이오의약품의 다양한 차이가 있다. 약물로 바이오의약품은 합성의약품과 비교하여 여러 장점을 가지고 있다. 바이오의약품은 치료를 위해 매우 정확한 표적-특이적(target-specific) 특성을 가지고 있다. 이는 확실한 약리학적 기전을 가지고 있다는 것을 의미하며 또한 이에 의한 과잉 약리작용으로 부작용이 발생한다는 특성을 의미한다. 따라서 생물 유래 물질을 이용하여 의약품을 제조하기 때문에 고유 독성이 낮고 작용기전이 명확하다. 반면에 합성의약품은 표적-특이성이 부족하여 비표적-부작용(non-target side effects)을 유발하는 특성이 있다. 이와 같이 바이오의약품의 표적-특이적 약리작용은 약물 개발에서 혁명적인 접근법으로 인식되는 계기가 되었다. 예를 들어 B세포 계열의 림프종에서 발현되어 CD20 항원을 표적으로 하는 키메라 단일클론항체(chimeric monoclonal antibody)인 리툭시맙(rituximab)이 비호킨성 림프종을 포함하여 다양한 질환에 처방되는 것을 예를 들 수 있다, 이와 같이 바이오의약품의 표적-특이성으로 희귀·난치성 질환에 효과가 뛰어나 주로 기존 치료법에 대한 미충족 수요가 높은 퇴행성·난치성 질환 치료제 또는 환자 맞춤형 표적치료제로 사용된다.
○ 면역원성(immunigenecity): 면역원성은 면역에 사용되는 동물종의 면역응답을 자극하는 항원 강도를 뜻한다. 바이오의약품을 개발할 때 반드시 고려해야 하는 면역원성은 개발과정에서 안정성 문제를 야기한다. 그러나 바이오의약품의 면역원성에 대한 연구와 분석에 대한 인식이 부족한 실정이다. 일반적으로 합성의약품은 <표>에서처럼 1 kDa 이하의 크기로 너무 작아 항원 결정기가 없어 그 자체적으로 면역반응을 유도하지 못한다. 따라서 합서의약품은 항원결정기를 갖춘 단백질과 공유결합을 통해 면역반응을 유도할 수 있으며 단백질과의 복합체를 통해 면역반응을 유발하는 화학물질을 합텐 (hapten) 이라고 한다. 그리고 합텐이 단백질과 공유결합하는 과정을 합텐화 (haptenization) 이라고 한다. 그러나 특히 바이오의약품 중 항체의약품은 다 양한 항원결정기 (antigenic epitope)를 포함하고 있어 임상에서 면역원성 (immunogenicity) 유발 가능성이 높고, 유발된 면역원성은 약효, PK, 안전성에 심각한 영향을 미칠 수 있다. 따라서 바이오의약품을 개발하기 위해서는 항체의 작용기전과 항체의 종류에 따라 effector 활성을 포함하는 약효평가법과 함께 면역원성 평가가 수행되어야 하는데 우리나라는 다양한 바이오의약품에 대한 면역원성 평가에 관한 가이드라인이 제정되어 시행되고 있다.
<표> 합성의약품(small molecules)과 바이오의약품의 차이점 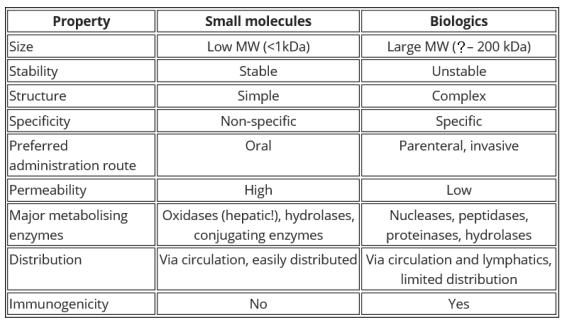
3. 바이오의약품의 종류
1) 생물학적 제제
○ 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품으로서 물리적·화학적 시험만으로는 그 역가와 안전성을 평가할 수 없는 백신·혈장분획제제 및 항독소 등을 말한다.
2) 유전자재조합의약품
○ 유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품을 의미하며. 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등이 포함된다. 세포배양의약품이란 세포배양기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품이다.
3) 세포치료제
○ 세포치료제란 살아있는 자가, 동종, 이종 세포를 체외에서 배양·증식하거나 선별하는 등 물리적, 화학적, 생물학적 방법으로 조작하여 제조하는 의약품을 말한다. 다만, 의료기관 내에서 의사가 자가 또는 동종세포를 당해 수술이나 처치 과정에서 안전성에 문제가 없는 최소한의 조작(생물학적 특성이 유지되는 범위 내에 서의 단순분리, 세척, 냉동, 해동 등)만을 하는 경우는 제외한다.

4) 유전자치료제
○ 유전자 치료제는 질병치료 등의 목적으로 인체에 투입하는 유전물질 또는 유전물질을 포함하는 의약품으로, 유전물질 발현에 영향을 주기 위하여 투여하는 유전물질 또는 유전물질이 변형되거나 도입된 세포를 포함하는 의약품을 의미한다. 아래의 <그림>에서처럼 유전자 치료제는 치료 방법과 전달방식에 따라서도 구분할 수 있는데, 유전물질을 직접 환자에게 투여하는 In vivo 유전자치료와 체외에서 먼저 목적 세포에 치료유전자를 도입한 후 유전물질이 이입된 세포를 환자에게 주입하는 Ex vivo 유전자 치료가 있다<출처: 식품의약품안전처 생물학적 제제 등의 품목허가심사 규정 고시; 약학정보원 Biological product-biosimilars, 최선>
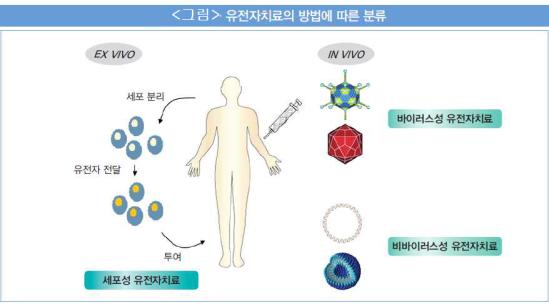
4. 바이오의약품(biologics), 바이오시밀러(biosimilars) 그리고 바이오베터(biobetter)
○ 특허기간이 끝난 합성의약품의 복제약인 'Generics'은 원래 약물과 동일한 구조를 가지지만 바이오의약품은 생물체에서 생성되기에 동일한 복제품을 만들 수 없고 최대한 유사성을 가진 구조를 가진 제품이라는 의미로 바이오시밀러(biosimilars)이라고 한다. 바이오시밀러의 경우 원래의 약과 동일한 공정으로 제조하지는 않으나 임상실험을 하여 혈액검사 결과, 생물학적으로 거의 동일한 효과를 낼 경우 동등성인증을 받아 바이오시밀러로 인정된다. 이와 같이 최초로 개발된 바이오의약품의 특성에 유사하거나 효능 향상을 위해 변화를 유도한 바이오시밀러 및 바이오베터 등의 제품이 개발되고 있다.
① 바이오의약품(biologics): 초기 바이오의약품은 펩티드(peptides), 핵산-유래 복합체(nucleic-acid-based compounds), 사이토카인(cytokines), 대체효소(replacement enzymes), 재조합단백질 (recombinant proteins), 그리고 단일클론항체(monoclonal antibodies) 등이었지만 살아있는 실체((living entities)인 세포, 조직 등이 포함된다. 따라서 바이오의약품은 인체, 동물 그리고 미생물 등의 다양한 기원에서 생명공학적 및 최첨단의 추출 방법을 통해 유래된다, 그러나 국가별로 그 정의가 상이한 측면이 있지만 우리나라는 항체치료제, 유전자재조합의약품, 세포배양의약품, 세포치료제, 유전자치료제, 기타 식품의약품안전처장이 인정하는 생물학적 제제 등으로 분류된다.
② 바이오시밀러(biosimilars. 동등생물의약품): 바이오시밀러는 바이오의약품 중 오리지날 제품의 특허만료로 인해 복제약으로 개발한 것을 의미한다. 그러나, 바이오의약품은 화학합성의약품과 달리 세포 배양 등의 생물공정을 거치면서 오리지날 의약품과 동일하게 만드는 것은 불가능하다. 따라서 오리지날 바이오의약품의 특허만료 후 유사하게 제조되는 것을 통칭하여 바이오시밀러 라고 하며, 이는 기존의 화학합성의약품과는 다르게 특성규명을 통해 유사성을 입증하고 임상시험을 통한 동등성을 입증해야 하는 어려움이 있다. 바이오시밀러 개발에 있어서 가장 큰 장벽 중의 하나는 항원성 발생이라고 할 수 있다. 바이오시밀러에는 중화항체((Neutralizing antibody, 병원체나 감염성 입자가 신체에 침투했을 때 생물학적으로 미치는 영향을 중화하여 세포를 방어하는 항체)뿐만 아니라 불순물에 대한 항체, 생산물 연관 물질(product related substance)에 대한 항체 등 다양한 항체가 발생할 수 있다. 이러한 항체의 발생은 바이오의약품의 효과에만 영향을 미치기도 하지만 안전성에도 영향을 미치는 경우가 발생하고 있다. 이러한 결과로 급성 아나필락시스 등이 발생하거나 과민성 면역반응이 나타날 수 있어 다양한 항체 검사 방법과 측정법 이 적용되고 있다. 이에 따라 최근에는 오리지날과 동일한 당사슬구조임을 밝히기 위해 질량분석기를 이용한 구조 특성 규명 이 거의 필수로 진행되고 있으며, 그 외에도 생산과정 중 amidation, phosphorylation 등 아미노산 및 결합의 변형에 대한 확인도 필수적으로 진행되고 있다(출처: Bioin스페셜 WebZine 2012년 28호, 바이오의약품의 현황과 개발 동향). 대표적인 바이오시밀러 단백질 치료제로는 인슐린, 성장호르몬, 이터페론알파, G-CSF, EPO 등이 있으며 항체 의약품인 휴미라(TNF-α 억제제), 허셉틴(HER2 억제제), 엔브렐(TNF-α 억제제), 아바스틴(VEGF 저해제), 리툭산(CD20 억제제), 레미케이드((TNF-α 억제제) 등이 있다.
③ 바이오베터(biobetter, 개량생물의약품): 바이오베터란 기존의 오리지날 제품을 개량하여 효능과 안전성에서 더 나은 특성을 가지도록 만든 바이오의약품을 일컫는 말로써, 슈퍼바이오시밀러라고 하기도 하며, 이러한 것은 더 적은 함량으로도 동일한 효과를 얻을 수 있는 것, 단백질공학으로 불필요한 부분을 제거한 것, 제형을 변경하여 안정성이 증가된 것, 서방형으로 방출되어 지속성이 증가된 것 등 매우 다양한 형태로 개발되고 있으며, 현재까지의 제품은 주로 Pegylation이나 Glycosylation 등의 기술이 적용되어 새로운 제품들이 개발되고 있다(출처: Bioin스페셜 WebZine 2012년 28호, 바이오의약품의 현황과 개발 동향). 예를 들어 바이오베터는 단백질을 주성분으로 포함한 제제로 재조합사이토카인, 호르몬 등의 단백질 치료제와 단클론항체 등의 미충족 수요를 개선한 의약품 등이 있다. 이러한 의약품은 제형변경을 통해서 투여의 편의성을 개선하거나, 고분자 접합, 단백질 융합 등의 단백질 엔지니어링 기술을 이용하여 반감기를 증대시키기도 한다.또한, 약효는 증가시키고 부작용은 개선하기 위해 Affinity-maturation, Fc-engineering, bi-specific antibody 등의 항체-엔지니어링 기술을 사용하기도 한다. 항체의 경우에는 동일한 target을 사용하는지 여부로 항체 신약과 구분하기도 한다. 미국 FDA에는 바이오베터라는 별도 허가 트랙이 없다. 바이오의약품이 FDA에서 허가를 받는 경우의 수는 신약 아니면 바이오시밀러 둘 중 하나다. 바이오베터는 주로 약의 개발 유형을 구분할 때 쓰는 개념이고 바이오신약은 허가 기준으로 나눌 때 사용하는 개념이다. 실제 최근 전세계적으로 FDA 허가를 받는 대부분의 바이오신약은 바이오베터로 개발된 제품이라고 추정되고 있는데 바이오베터를 개발하려면 기존 의약품의 단백질 구조에 대한 완벽한 이해가 있어야 한다. 반면 미국에서 합성의약품의 경우 기존 약을 업그레이드한 ‘개량신약’은 신약과의 구별이 명확해 개량신약에 대해 허가 트랙이 별도로 돼 있다.