1. TGN1412 사건의 원인과 MABEL의 탄생
○ TGN1412 사건의 발생기전: 백혈병과 만성 염증성 질환의 치료를 위하여 개발된 TGN1412는 제1상시험에서 건강한 사람들의 사망과 면역학적 이상을 유발하여 치명적인 손상을 유발하였다. TGN1412은 단일클론 항체(Anti-CD28 monoclonal antibody)로 백혈구 표면에 위치한 면역계 단백질인 CD28에만 특이적으로 결합한다. 결합에 의한 CD28 활성화는 염증성 cytokine의 과도한 분비로 염증성 혈관손상과 다발성장기분전을 유도한다. Cytokine의 과도한 분비를 cytokine storm(사이토카인 폭풍)이라고 하는데 TGN1412는 이를 유도한 것으로 이해되고 있다.
○ TGN1412 사건의 핵심 원인: 일반적으로 합성의약품에 대한 임상시험에서 안전용량의 확보는 임상최대권장초기용량 (meximum recommended starting dose, MRSD) 산출로 이루어진다. 즉 MRSD는 최초로 인체에 투여할 수 있는 최대용량으로 아래와 같이 13주 반복투여독성시험 및 기타 생식독성 및 발암성시험을 통해서 추정된 독성용량기술치(toxic dose descriptor)인 NOAEL(no observed adverse effect level, 최대비독성용량 )이다. 비독성이란 non-adverse effect로 영어로 표현되는데 독성이라고 판단하지 되지 않는 시험물질에 의한 변화를 의미한다. 예로 특정용량에서 항암효과가 있는데 탈모가 확인되었다. 이러한 경우 toxicity-benefit analysis(독성-유효성 분석)에 기반하여 비록 독성이 있더라도 치료효과가 크다면 비독성으로의 분류를 들 수 있다. 또한 시험물질 투여기간에 나타난 시험물질의 변화가 시험물질을 제거한 후 회복시험을 통해 없어진다면 이러한 변화도 비독성으로 분류될 수 있으며 이의 용량을 NOAEL로 설정할 수 있다. 이와 같이 시험물질의 변화가 있는 용량을 NOAEL로 설성하는 이유는 독성시험을 통해 용량-반응관계를 추정하여 임상시험에서 용량 변화에 따른 반응을 예측하기 위함이다. TGN1412도 아래의 <표>와 같이 MRSD가 3 mg/kg가 추정되었다. 여기서 유의할 것은 바이오의약품의 정맥 투여일 경우에는 종간 SF(안전계수, safety factor) 및 HED( 인체등가용량, human equivalent dose) 가 적용되지 않고 단지 인체 내의 민감도 차이에 대한 SF 10만 적용된다. 이는 합성의약품의 정맥투여 경우에 혈액을 빠져나가 전신으로 이동할 수 있지만 바이오의약품은 혈관을 빠져나갈 수 없어 종간 차이가 없기 때문이다. TGN1412의 MRSD는 원숭이(cynomolgus monkey)에 대한 반복투여독성에서 추정된 NOAEL이 이용되어 임상시험에서 응용되었다. 그러나 결과적으로 원숭이의 1/10 정도 용량의 TGN1412이 인체에 투여되었지만 원숭이에게는 부작용 및 독성이 나타나지 않았지만 인체에서는 사망과 장기부전 등의 부작용이 확인되었다. 임상시험에서 cytokine storm이 원인으로 TGN1412 사건이 발생한 것으로 추정됨으로 인체 CD28 수용체가 원숭이보다 TGN1412에 대한 민감도가 훨씬 민감하다는 것으로 의미한다. 결론적으로 합성의약품에서 NOAEL를 이용한 MRSD는 항원으로 작용이 가능한 유전자-재조합 단백질의 바이오의약품은 종간 수용체(receptor) 민감도의 차이를 고려한 임상안전용량 산출 방법이 제시되어야 한다.

○ MABEL을 이용한 MRSD 산출: TGN1412 임상시험 사고 후 유럽의약품청 (EMEA, European Medicines Agency) 이 2007년에 발행한 가이드라인 ’Guideline on strategies to identify and mitigate risks for first-in-human clinical trials with investigational medicinal products ( EMEA, 2007) ‘은 임상시험에서 초기투여용량의 위험성 감소를 위해 제작된 가이드라인이다. 바이오의약품 중에서도 세포치료제, 유전자치료제 등은 합성의약품과 같이 MRSD 산출을 위해 NOAEL을 사용하지만 생물학제제 특히 유전자재조합의약품 (유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품을 의미하며. 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등이 포함) 의 MRSD 산출을 위해서는 MABEL (minimum anticipated biological effect level, 생물학적영향-최소추정용량)이 적용된다. M ABEL이란 인체, 동물 그리고 in vitro 시험에서 외형적으로 나타나는 독성반응을 비롯하여 치료 개념의 측정 가능한 약리학적 유효반응 등의 측면에서 그 어떠한 변화 및 영향도 없이 분자-생화학적 수준에서 반응이 시작되는 용량이다. 따라서 MABEL은 약물의 유효성을 유도하는 최소용량을 의미하는 MED(minimum effective dose, 최소효능용량), 그리고 MED와 동일 개념인 약리학적 활성 용량인 PAD (pharmacologically active dose) 의 이하의 용량이 된다(Muller, 20009). 아래의 <그림>을 통해 다양한 합성화학물질의 POD(point of departure) 또는 독성용량기술치인 NOEL 및 NOAEL과의 비교를 통해 바이오의약품의 M ABEL 용량 위치를 확인할 수 있다. NOEL과 NOAEL은 치료의 용량 범위 및 독성의 용량 범위에 포함될 수 있지만, MABEL은 효능이든 독성이든 그 어느 용량영역에도 포함되지 않고 단지 이러한 반응들이 나타나기 전의 초기 용량 범위에 위치한다. 바이오의약품은 낮은 용량에서는 원하는 효능이 있을 수 있지만 높은 용량에서는 효능 외의 원하지 않는 다른 반응이나 독성이 나타나는 특성이 있다. 이러한 이유로 가능한 낮은 농도에서 분자-생화학적 수준을 확인하여 인체투여용량인 MRSD가 설정되어야 한다. 바이오의약품의 약리작용과 독성작용에 있어서 분자-생화학적 수준이란 리간드-수용체(ligand-receptor) 반응의 적절과 과잉에 기인한다. 바이오의약품은 효소 및 항체 등의 고분자로 생체 또는 세포 내의 단백질 수용체와 결합하여 리간드-수용체 약리작용을 유도한다. 그러나 바이오의약품인 리간드가 약리작용을 넘는 수준의 리간드-수용체를 형성하게 되면 독성을 유발한다. 특히 효능과 독성의 반응 사이의 용량 범위가 상당히 좁아 정확한 리간드-수용체의 용량-반응곡선이 필요하다. 실제로 수용체와 결합하는 리간드 바이오의약품은 미량에서도 생체에 큰 영향을 유도한다. 따라서 단순히 바이오의약품의 약리작용을 위한 용량의 선택에 있어서 일반 합성약물보다 더 높은 정확성이 요구된다. <그림>에서처럼 바이오의약품과 합성의약품 또는 SM(합성화학물질, small molecule)의 약리작용 및 독성작용의 용량 범위를 이용하여 각각의 MRSD를 산출할 수 있다. SM의 치료범위와 독성범위는 NOAEL의 기준으로 용량-반응곡선이 명확하게 분리되며 둘 범위가 멀수록 SM의 안전성은 높다. SM(합성의약품)의 NOEL은 외형적으로 어떤 영향도 나타나지 않는 용량으로 SM 종류에 따라 달라질 수 있지만, 치료범위를 포함하여 독성의 용량-반응곡선 상에 존재하는 NOAEL 시작전까지의 용량 범위이다. 합성의약품의 MRSD는 NOEL보다 NOAEL을 응용하여 산출된다. 그러나 바이오의약품의 MRSD는 MABEL을 이용하여 산출된다.
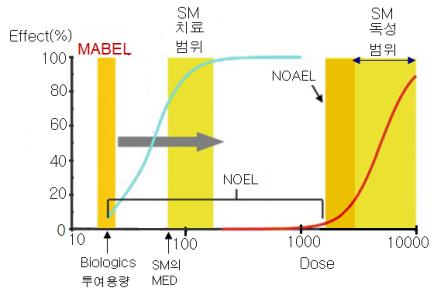
<그림> MABEL의 출발용량과 기타 POD와 관계: MABEL은 분자-생화학적 수준에서 반응을 시작되는 용량이며 약물의 유효성을 유도하는 최소용량을 의미하는 MED(minimum effective dose, 최소효능용량)의 이하가 된다. 합성의약품 또는 SM(small molecule, 합성화학물질)의 MRSD는 NOEL보다 NOAEL을 응용하여 산출된다. 그러나 바이오의약품(biologics)의 MRSD는 MABEL을 이용하여 산출된다( Brian, 2013) .
○ TGN1412의 MRSD 재산출을 위한 3대 요소: MABEL을 기반으로 바이오의약품 TGN1412에 대한 MRSD 산출을 위한 3대 요소는 아래의 <표>와 같이 요약된다. 바이오의약품의 MRSD 산출에서는 저분자 합성신약에 대한 NOAEL이 아니라 MABEL이 사용되며 또한 SF는 종간 RO의 비로 대체되는 방법이지만 3대 요소도 리간드-수용체의 결합에 대한 이해가 우선이다. 만성염증 및 백혈병 치료제로 개발된 TGN1412는 T-세포의 수용체 CD-28에 결합하여 약리효능을 발휘하는 기전으로 개발되었기 때문에 CD-2 8에 대한 TGN1412의 RO에 대한 이해가 MRSD 산출에 중요한 요소가 된다.

○ MABEL을 이용한 TGN1412의 MRSD 재산출: 이와 같은 3개 요소에 대한 이해를 바탕으로 ① in vitro 농도-반응곡선 확인: 인체 및 동물에서 바이오의약품의 표적세포를 이용한 바이오의약품과 표적수용체의 RO 확인, ② 인체 및 동물의 in vitro의 용량-반응곡선과 랫드 및 원숭이 등의 in vivo 동물모델로부터의 용량-반응 관계를 이용하여 약리작용의 최저용량인 MED 이하의 분자-생화학적 수준에서 반응을 시작되는 용량인 MABEL을 산출, ③ 앞의 두 항목을 통해 SF 및 MABEL을 응용하여 MRSD = MABEL/SF, SF=사람의 RO/동물의 RO로 TGN1412에 대한 MRSD를 재산출 등의 과정으로 MRSD 산출이 가능하다. <표>에서는 2006년 바이오의약품 TGN1412의 임상시험에서 NOAEL을 이용한 MRSD와 2007년 개발된 MABEL을 이용하여 산출한 MRSD가 비교되었다 (Patrick, 2009) . 두 종류의 MRSD는 POD의 기원에 있어서 차이가 있다고 할 수 있는데 전자는 독성시험으로부터 얻은 POD를 이용하여 산출되었기 때문에 독성학적 평가 (toxicological assessment), 후자는 약리학적 접근을 통한 POD를 산출하였기 때문에 약리학적 평가 (pharmacological assessment) 로 구분된다. 독성학적 평가를 통한 MRSD 산출은 2005년 미국 FDA에서 출간된 가이드라인인 ‘ FDA Guidance: Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers(US-FDA, 2005)’로 건강한 성인 자원자들의 임상시험에 있어서 임상최대권장초기대용량 설정에 관한 가이드라인에 따라 이루어졌다. Step 1에서 반복투여독성시험을 통해 랫드 및 원숭이 (cynomolgus monkey) 에 대한 TGN1412의 NOAEL은 각각 100 mg/kg과 30 mg/kg으로 추정되었지만, 안전성을 높이기 위해 2종 중 낮은 NOAEL이 MRSD 산출을 위해 선택된다. Step 2에서 독성시험을 산출된 NOAEL, 그리고 동물 및 인체의 Km을 이용하여 HED로 전환하는 과정이지만 ‘FDA Guidance‘에 따라 여기서는 적용이 되지 않는다. 정맥주사의 경우에 분자량이 100 kDa 이상이 되는 바이오의약품 등은 혈관 외부로 유출되어 다른 기관 및 생체 부위로 이동하여 독성을 유발할 가능성이 없어 HED 및 종간 SF를 적용하지 않는다. 결과적으로 사람집단의 민감도 차이에 대한 SF 10을 적용되어 MRSD는 3 mg/kg이 추정되었다. TGN1412 임상시험 사고 후 유럽의약품청 (EMEA, European Medicines Agency) 이 2007년에 발행한 가이드라인 ’Guideline on strategies to identify and mitigate risks for first-in-human clinical trials with investigational medicinal products (EMEA, 2007) ‘은 임상시험에서 초기투여용량의 위험성 감소를 위해 제작된 가이드라인이다. 이에 따라 NOAEL을 이용한 MRSD 산출, 그리고 MABEL을 이용한 MRSD 산출 및 결과 비교가 아래의 <표>에 이루어졌다. 여러 종의 표적세포 및 in vivo의 PK/PD 모델을 응용하여 10%의 표적 수용체를 포화시키는 농도가 원숭이에서 0.1 mg/kg로 확인되어 약리적 효능이 나타나지 않는 최대농도의 MABEL로 결정되었다 . 원숭이와 인체의 RO에 대한 차이가 5배, 즉 인체에 있어서 TGN1412의 수용체 친화도가 5배 정도 높다. 수용체 친화도가 높다는 것은 더 민감하다는 것이며 Kd가 낮으면 특정 용량에서 RO가 높다는 것을 의미한다. 따라서 원숭이와 사람 간의 종간 SF는 5가 되어 MRSD = 0.1 mg/kg ( ÷ ) 5 = 0.02 mg/kg이 된다. 이를 통해 바이오의약품 TGN1412의 임상시험에서 초기용량으로 NOAEL을 이용한 MRSD가 MABEL을 이용한 MRSD보다 무려 150배 정도 높았다는 것을 확인할 수 있으며 이는 림파구 사멸의 과잉을 유도하여 임상시험 사고 발생의 원인으로 고려된다.

2. 바이오의약품의 독성시험과 MRSD 산출에 있어서 고려할 핵심 사항
① 바이오의약품 중 유전자재조합단백질과 합성의약품의 용량-반응곡선에서 차이점 : 항체의약품인 경우에 낮은 농도와 높은 농도에서 작용제(agonist)와 길항제(antagonist)의 상반된 기능이 존재하여 질환 치료에 있어서 용량별 기능의 확인은 중요하다.
② 바이오의약품의 비경구적 주사에 의한 독성학적 문제점: 바이오의약품은 표적기관에 직접적으로 주입되는 경우가 많이 투약과 관련된 부작용(infusion-related reactions)인 주입부위 반응(injection site reactions, ISR), 그리고 정맥투입을 통해 주입 반응(infusion reaction)을 유도할 수 있다, 이는 바이오의약품의 표적기관 투여에 의한 대표적인 반응이다. 실제적으로 대부분의 CRO 기관에서 뇌실내 주사(intracerebroventricular injection, ICV), 척수내 주사 (intrathecal injection) , 뇌실질내 주사 (intracerabral ventrical injection)와 뇌내주사(intra에 대한 주사 미숙으로 유효성 및 독성에 대한 올바른 자료 획득 및 이에 의한 해석이 어려움이 있는 것이 사실이다, 특히 주사에 의한 ISR이 시험물질에 의한 변화로 판단되어 표적기관으로 설정되는 것은 지양되어야 한다. 이는 비임상시험에서 동물에 투여와 임상시험에서 사람투여의 정밀성에서 있어서 큰 차이가 있다, 독성시험은 임상시험의 예측인데 이러한 차이를 고려하지 않고 표적기관 또는 시험물질에 의한 변화로 판단하는 것은 임상시험의 예측 목적에서 벗어날 수 있다.
③ 바이오의약품의 biodistribution: 바이오의약품의 비임상시험에서 합성의약품의 동태학(kinetics: PK 또는 TK)과 같은 역할을 하는 것이 biodistribution(생체내 분포) 시험이다, Biodistributuion이란 바이오의약품이 표적위치 외의 다른 장기나 기관으로 이동 유무와 표적위치에서의 지속성을 확인하는 시험을 의미한다. 대부분의 바이오의약품은 분자량이 크기 때문에 합성의약품처럼 혈관계를 통해 다른 위치로 이동할 수 없어 이동시 부작용이 우려하기 때문에 비임상시험에서 수행된다 점을 숙지하여야 한다.
④ MABEL을 이용한 TGN1412의 MRSD 재산출: 유전자재조합단백질의 MRSD 산출에 있어서 다음과 같은 3개 요소에 대한 이해를 바탕으로 추정되어야 한다; ① in vitro 농도-반응곡선 확인: 인체 및 동물에서 바이오의약품의 표적세포를 이용한 바이오의약품과 표적수용체의 RO 확인, ② 인체 및 동물의 in vitro의 용량-반응곡선과 랫드 및 원숭이 등의 in vivo 동물모델로부터의 용량-반응 관계를 이용하여 약리작용의 최저용량인 MED 이하의 분자-생화학적 수준에서 반응을 시작되는 용량인 MABEL을 산출, ③ 앞의 두 항목을 통해 SF 및 MABEL을 응용하여 MRSD = MABEL/SF, SF=사람의 RO/동물의 RO로 TGN1412에 대한 MRSD를 재산출 등의 과정으로 MRSD 산출이 가능하다.