1. 알츠하이머 질환의 발생율
○ 알츠하이머 질환은 기억력의 점진적인 퇴행을 가져오는 뇌의 이상에서 오는 병이다. 또한 알츠하이머는 일상생활에 곤란을 겪을 정도로 사고, 기억, 추론 등의 행위에 심각한 지적 기능의 상실을 가져오는 치매(dementia)증에 이르게 된다. 오늘날, 65세 이상의 10퍼센트, 85세 이상의 거의 절반에 이르는 노인들에게 영향을 주는 치매증의 가장 일반적인 원인이다. 우리나라에서는 <그림-1>에서처럼 치매의 여러 원인 중 69% 정도가 알츠하이머 유형이다.
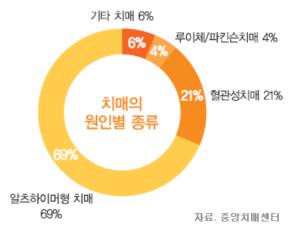
<그림-1> 알츠하이머 치매의 발생율
2. 알츠하이머 질환의 발생 기전
1) 베타 아밀로이드 단백질(beta-amyloid protein) vs 타우 단백질(tau protein)
○ 알츠하이머병의 원인과 발병 기전은 아직 정확히 밝혀지지 않았지만, 일반적으로 베타 아밀로이드 단백질(beta-amyloid protein)과 타우 단백질(tau protein)이 발병에 영향을 미치는 것으로 추정되고 있다<그림-2>. 베타-아밀로이드 (beta-amyloid) 단백질 조각들이 뭉쳐져서 만들어진 베타-아밀로이드 신경반(beta-amyloid plaques)와 타우 단백질의 과인산화로 신경섬유다발(neurofibrillary tangles), 즉 플라크와 탱글에 의해 신경세포가 잘 작동하지 못하고, 더 나아가서는 신경세포의 파괴에 관여하는 것으로 알츠하이머 질환의 기전으로 추정되고 있다.
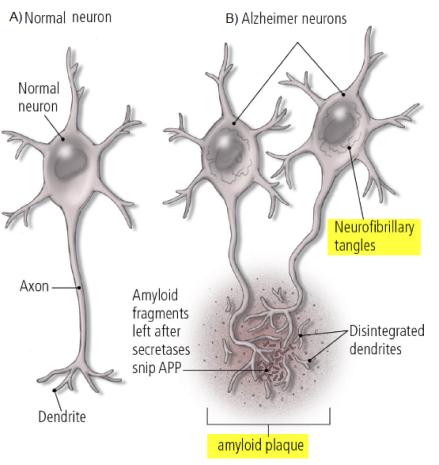
<그림-2> 정상 신경세포와 알츠하이머 신경세포의 비교: 베타-아밀로이드 신경반(beta-amyloid plaques)과 신경섬유다발(neurofibrillary tangles)
2) 베타 아밀로이드 단백질(beta-amyloid protein)에 의한 가설
① 3 종류의 secretase에 의한 APP 부위별 절단과 프라크 형성기전 : 베타 아밀로이드는 아밀로이드 전구체 단백질(amyloid precursor protein, APP)로 유래한다. 신경에 존재하는 APP의 주요한 아이소폼은 695개에서 770개의 아미노산 잔기로 구성되어 있다. APP는 신경세포의 막에서 존재하여 신경 손상에 대한 복구와 신경세포 성장에 중요한 역할을 한다. 그러나 APPsms 단백질 분해효소(protease)의 일종인 다양한 secretase에 의한 비정상적인 분해로 의해 알츠하이어의 원인이 된다. <그림-2>의 A)에서처럼 APP는 2개의 효소인 α(alpha)와 γ(gamma)-secretase(절단효소)에 의해 조각으로 분해된다. 이들 조각은 분해되어 배출되기 때문에 신경세포에 독성을 유발하는 영향이 없다. 그러나 α-secretase 효소의 활성이 저해되면 APP는 <그림-2>의 A)와 B)에서처럼 β-secretase (BACE)와 resenilin 1/presenilin 2, nicastrin, PEN-2와 APH-1 등의 복합체인 γ-secretase에 의해 분해된다. 이와 같은 결과로 APP에서 잘려나온 조각은 Aβ40에서 Aβ42 등을 비롯하여 Aβ1-38에서부터 Aβ1-43까지 여러 가지 길이의 펩타이드가 생성된다. 특히 Aβ42 조각이 신경반 또는 프라크 형성에 가장 높은 응집력을 가진 것으로 알려졌다. 이들 조각들은 아미노산으로 구성된 A-beta peptide(펩타이드)로 올리고머 (oligomer: 아미노산과 같은 수 개~수십 개의 단량체(monomer)가 연결된 분자)이 며 축적에 의해 대뇌 피질의 세포외기질에서 beta-amyloid plaques로 형성된다. 이러한 이유로 알츠하이머병을 진단할 때 beta-amyloid plaque가 주요한 척도, 즉 발병 유무의 바이오마커로 사용된다.
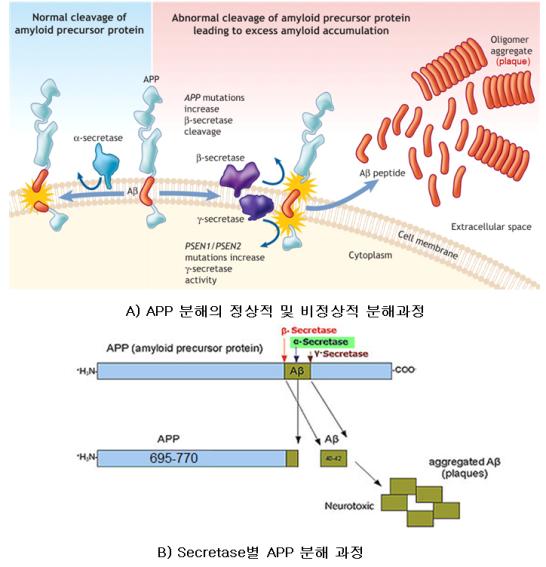
<그림-3> 베타 아밀로이드의 정상적인 분해 및 비정상적 아밀로이드 축적 기전
② η(eta)-secretase와 δ(delta)-secretase에 의한 APP의 분해(Zhang et al., 2020):
η(Eta)-secretase에 의한 APP 분해는 비교적 최근에 알려졌다. <그림-3>에서처럼 α-와 β-secretase에 의한 정상적인 절단 후 2차로 η-secretase는 APP의 504-505 아미노산 사이를 절단하여 아밀로이드 베타( amyloid-β, Aβ)의 생성 방법이다. η(Eta)-secretase에 의한 절단은 Aβ1-16 등이 있으며 신경독성을 유발한다. 또한 δ(delta)-secretaseeh 확인되었는데 APP의 586- 695 사이를 절단하며 유일하게 노화-의존성 절단효소이며 Tau 단백질과 연관하여 알츠하이머 질병을 유발한다.
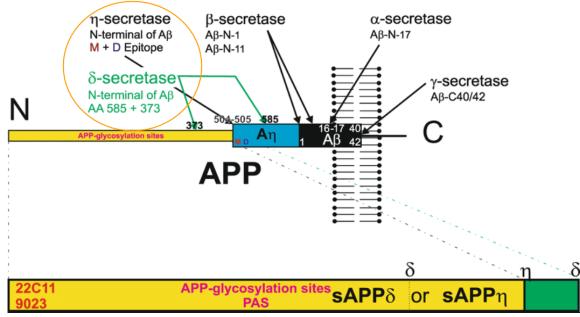
<그림-3> η(Eta)-secretase와 δ(delta)-secretase에 의한 APP의 분해
3) 타우 단백질의 과인산화에 의한 신경섬유다발(neurofibrillary tangles)의 가설
① Tau 단백질과 미세소관의 파열: Tau는 정상적인 신경세포의 축삭(axon)에서 미세소관(microtubule) 안정화에 기여하는 미세소관-관련 단백질(microtubule-associated protein, MAP) 중의 하나이다. 또한, 타우단백질은 신경세포의 발생단계에서 axon 발달, 미세소관 조립 (assembly) 및 활동성(dynamics)의 조절, 그리고 mitochondria 등 세포 내 기관(organelle)들의 axon을 통한 이동 조절에 대한 역할을 한다. 이러한 역할에 기인하여 타우단백질은 뉴런이 존재하는 중추신경계(CNS)와 말초신경계(PNS)뿐만 아니라 희소돌기 신경교세포(oligodendrocyte) 및 성상세포(astrocyte) 등의 다양한 신경-관련 세포에서 발현되는 고도의 용해성 단백질이다. 그러나 <그림-4>의 A)에서처럼 정상 신경세포에서와는 다르게 <그림-4>의 B)에서처럼 알츠하이머의 신경세포에는 타우 단백질의 문제로 미세소관이 해체된다. 이와 같이 분리된 타우단백질의 축적에 의한 응집체를 신경섬유다발(neurofibrillary tangles, NFT)이라고 한다.
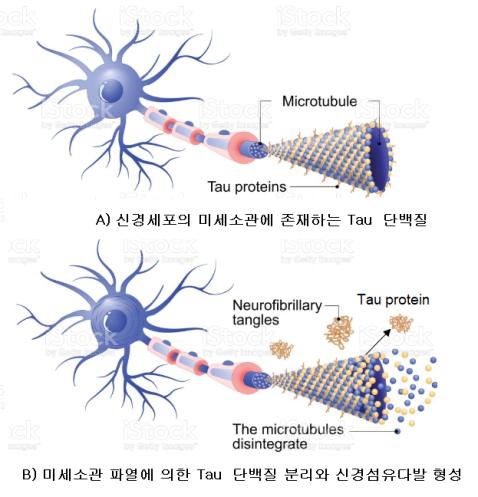
<그림-4> Formation of neurofibrillary tangles (NFTs) by the tau protein
② 신경섬유다발의 기전- 타우단백질의 인산화: 타우단백질의 과인산화는 신 경섬유다발(neurofibrillary tangles, NFT)의 원인이다. 타우 단백질 인산화효소(tau protein kinase)에 의해 과도하게 인산화(phosphorylation)되면 단백질에 변성이 생긴다. 정상적인 타우 단백질이 변형되면 신 경섬유다발(neurofibrillary tangles, NFT)뿐만 아니라 이중나선섬유(PHFs: paired helical filaments)가 유발된다. 과도한 인산화에 의한 타우단백질 응집체는 주로 신경세포의 세포체와 수상돌기에서 발견된다. GSK3β, Cdk5, PKA, MAPK, MARK, casein kinase 등 수 십가지의 kinase에 의해 tau 인산화가 유도된다. 타우단백질에는 다수의 serine/threonine phosphorylation, tyrosine phosphorylation, acetylation, isomerization, nitration, glycation, ubiquitination, O-GlcNAcylation, cleavage by caspase 등의 posttranslational modification이 일어난다. 그러나 최근 연구에 의하면 타우단백질의 serine/threonine phosphorylation이 무정형 섬유 응집체 형성에 있어서 주요 역할을 하는 것으로 알려졌다. 즉, 타우단백질의 아미노산 서열 Ser202, Thr205와 Ser208의 인산화가 타우단백질의 비정상적 위치 (mislocalization)와 응축(aggregation)을 촉진하여 무정형 응집체 형성으로 NFT를 유도한다. <그림-5>의 2에서처럼 Ser202와 Thr205에서의 인산화는 타우단백질을 신경세포의 축삭(axon)에서 세포체(soma)와 수상돌기(dentrite)로의 이동을 유도한다. 또한, Ser202와 Thr205에서의 인산화와 더불어 <그림-5>의 3에서처럼 Ser208 인산화는 세포체에서의 필라멘트 형성을 통해 NFT를 유도하게 된다. 또한, Ser202와 Thr205에서의 인산화와 더불어 <그림-5>의 3에서처럼 Ser208 인산화는 세포체에서의 필라멘트 형성을 통해 NFT를 유도하게 된다. Thr205의 인산화는 proline-directed kinase 종류로 분류되는 mitogen-activated protein kinases (MAPK), cyclin-dependent kinase 5 (CDK5)와 glycogen stimulated kinase-3β (GSK-3β) 등의 효소를 통해 이루어진다. Ser208는 non-proline directed kinase 종류인 checkpoint kinase 1 (Chk1), casein kinase 1 delta (CK-1)와 tau-tubulin kinases (TTK) 등의 효소에 의해 인산화가 된다. 이들 non-proline directed kinase 효소들은 Ser202와 Thr205의 인산화를 유도하지 않는 것으로 추정된다. 이와 같은 인산화의 효소 차이는 타우-유도성 병리적 현상이 종마다 또는 신경섬유다발 형태에서 차이를 유발하는 원인으로 설명되고 있다. 타우 단백질을 따라 인산화될 수 있는 부위가 20개 정도이며 일반적으로는 4~5개만이 인산화된다. 특히 알츠하이머에서 타우단백질의 과인산화은 적어도 10개 아미노산에 인산화가 유도되어야 함으로 타우단백질의 과인산화 기전은 여전히 규명이 더 필요하다.
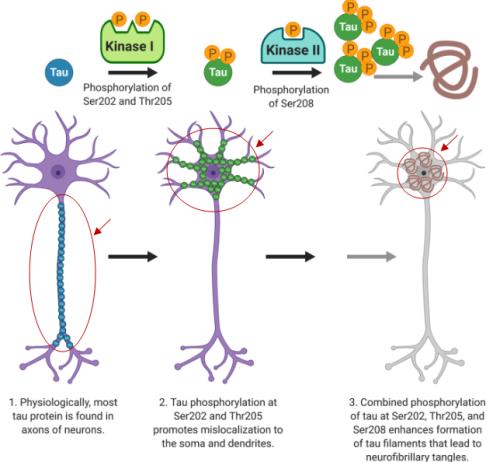
<그림-5> 타우단백질의 특정 아미노산 서열에 따른 신 경섬유다발 유도 기전
3. Beta-amyloid plaques 형성과 타우단백질의 신경섬유다발의 선행성
○ 아밀로이드 베타(amyloid-β)는 신경세포의 세포자멸(apoptosis)을 수 시간 내에 유도하지만 타우단백질에 의한 신경섬유다발은 수년 또는 수십년 동안에 걸쳐 발생한다. 특히 타우단백질의 과인산화는 베타-아밀로이드에 의한 아팝토시스를 피하기 윈한 신경세포의 방어기전으로 이해되고 있다. Beta-amyloid plaques 형성과 타우단백질의 신경섬유다발이 알츠하이머 질환의 주요 기전은 확실하지만, beta-amyloid plaques가 알츠하이머 질환의 선행인자라는 것에 대한 의문이 최신 연구에 의해 제시되었다. 뇌의 인지기능의 변화가 베타 아밀로이드 프라크의 형성보다 선행된 사실이 밝혀지며, 베타 아밀로이드가 알츠하이머의 원인이 아니라는 결론이 나온 것이다. Kelsey R. Thomas 등의 2020년 연구에 따르면 베타 아밀로이드 프라크가 생성 이전에 인지 기능의 변화가 선행된다는 것이 확인되었으며 이는 베타 아밀로이드가 알츠하이머의 원인이 아니라는 것을 의미한다. <그림-5>는 아밀로이드 축적과 신경퇴행과 관련하여 미세한 인지(기억력과 사고력) 어려움을 가진 환자군( subtle cognitive difficulties, Obj-SCD)의 153명, Obj-SCD보다 정상인 환자군 ( CN=cognitively normal)의 305명, 그리고 경도인지장애(mild cognitive impairment, MCI)환자군의 289명 등 전체 747 알츠하이머 환자를 대상으로 4년 동안 1년마다의 베타 아밀로이드 플라크 수준을 양전자방출단층촬영(positron emission tomography, PET) 결과이다. 미세한 인지(기억력과 사고력) 어려움을 가진 환자군( subtle cognitive difficulties, Obj-SCD)에서 Obj-SCD보다 정상인 환자군 ( CN=cognitively normal)보다 아 밀로이드 축적이 빠르게 나타났다( Figure 1 depicts the trajectories of amyloid PET by group and table 3 shows the model estimates. There was a significant interaction between cognitive group and time such that, relative to CN participants, participants with Obj-SCD had a faster increase in amyloid PET SUVR (t[1109.08] = 2.58, p = 0.010, r = 0.077). Participants with MCI did not differ from CN participants (t[1133.51] = 1.13, p = 0.258, r = 0.034) or participants withObj-SCD(t[1173.95] = 1.59, p = 0.113, r = 0.046) in the rate of amyloid accumulation over 48 months). 특히 뇌 부위 중 내후각피질(entorhinal cortex)도 훨싼 더 빠르게 얇아지는 것이 관찰되었다. 또한 경도인지장애(mild cognitive impairment, MCI)환자군에서 아밀로이드 축적은 양적인 측면에서는 많지만, 축적 속도는 정상인 환자군 ( CN=cognitively normal)보다 차이가 없었다. 즉 알츠하이머 환자군에서 인지능력이 정상인 사람에서보다 미세한 인지능력이 있는 환자군에서 아밀로이드 축적 속도가 빠른 것으로 확인되었다. 이는 알츠하이머 치매의 원인으로 베타 아밀로이 드 단백질(beta-amyloid protein) 프라크와 타우 단백질(tau protein) 응집 중 베타 아밀로이드 플라크가 알츠하이머 치매의 원인이 아니라는 것을 의미한다. 그 동안 베타 아밀로이드 플라크가 알츠하이머 원인으로 표적삼아 개발된 수많은 치료제 후보약물들이 임상시험에서 실패하고 치료제가 없는 이유가 여기에 있는 것으로 추정된다. Kelsey R. Thomas 등의 2020년 연구에서도 이와 같은 이유로 치매 치료제 개발을 위해 표적을 바꿔야 한다고 주장하였다. 이에 알츠하이머 원인 중 베타 아밀로이 드 프라크보다 타우단백질 응집에 치료제 개발에 있어서 더 연구가 집중할 것으로 예상된다.
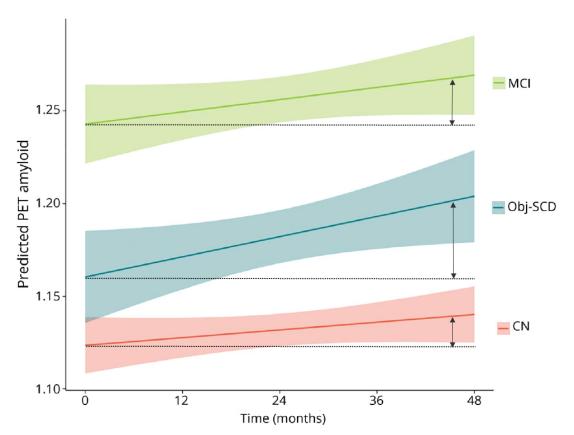
<그림-6> Trajectories of amyloid PET by cognitive group: Model-predicted values adjusted for age, education, sex, APOE e4 allele frequency, and baseline amyloid PET summary standardized uptake value ratio. CN = cognitively normal; MCI = mild cognitive impairment; Obj-SCD = objectively defined subtle cognitive difficulties. Shaded area represents 95% confidence intervals ( Kelsey R. Thomas, 2020).
