1. 알츠하이머 질환에 있어서 선행요인의 중요성
1) 선행요인의 중요성
○ 알츠하이머의 초기증상은 인지능력과 기억력의 감소가 대표적이다. 최근까지 알츠하이머 질환의 진행에 있어서 가장 대표적인 원인인 베타-아밀로이드 프라크(β-amyloid
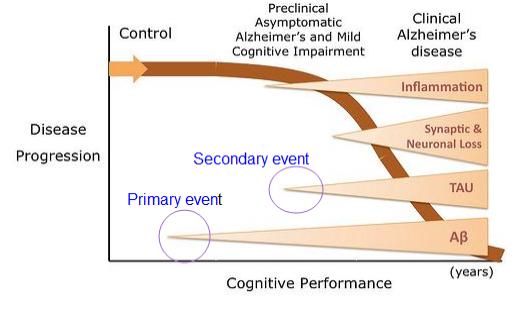
<그림-1> 알츠하이머 질환의 초기 증상인 인지장애의 발생에 있어서 선행요인
2) 알츠하이머 질환의 치료와 바이오마커의 필요성
① 알츠하이머의 바이오마커와 영상장비: <그림-2>는 정상 뇌에서 알츠하이머증상 발현 이전부터 인지장애 그리고 임상적 치매 판정까지의 바이오마커를 설정한 것이다 . 뇌조직 검사를 통해 이들 바이오마커를 확인은 불가능함으로 자기공명영상(MRI, Magnetic Reasonance Imaging)과 양전자방출단층촬영(PET, Positron Emission Tomography)을 통한 영상으로 확인된다. <그림-2>는 Amyloid PET imaging으로 뇌조직에 있는 Aβ 프라크에 방사선추적자(radiotracer)가 결합하여 정상인의 뇌와 알츠하이머 환자의 진단을 위해 Aβ 프라크가 바이오마크가 사용된 예이다.
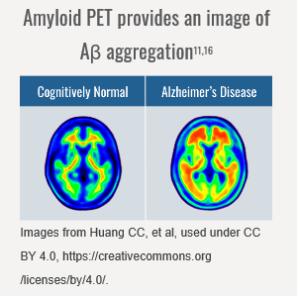
<그림-2> Amyloid PET imag ing
② Aβ 프라크의 선행요인에 따른 알츠하이머 진행에 따른 바이오마커<참고자료: 조양래 2020>: <그림-3>는 알츠하이머 증상 진행과 연관된 뇌조직의 변화와 임상적 증상의 바이오마크d와 이를 확인하는데 필요한 영상장비를 나타낸 것이다. 흑백사진은 정상인과 치매환자의 뇌 단층 비교를 한 것으로. 환자의 뇌에는 주름이 줄어들고 뇌의 부피가 감소되며 뇌강의 크기는 증가한 것이 확인이 된다. 컬러사진은 정상인 100 여명과 경도인지장애 환자 100 여명의 뇌의 구조비교 결과를 영상으로 비교한 것이다. 파란색 부분의 조직이 환자들에게 줄어든 것을 확인이 가능하고 증상을 보이기 이전부터 경도인지장애를 보이는 사람들의 뇌의 부피가 감소되었다. 도표는 정상상태에서 알츠하이머 치매로 전이되는 과정에서 뇌조직에서 나타나는 바이오마커와 필요한 영상장비를 표시한 것이다.
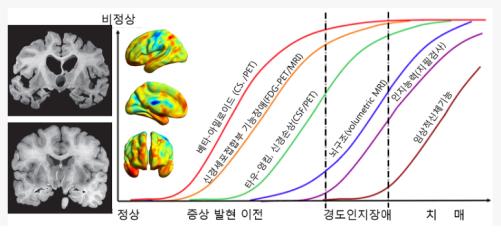
<그림-3> 알츠하이머 진행에 따른 바이오마커와 영상기술
2. 바이오마커에 대한 논쟁
① 논쟁 사항과 의미: <그림-3>에서처럼 뇌조직 영상을 통한 알츠하이머 진행에서 베타-아밀로이드(β-amyloid, Aβ), 신경접합부 기능장애(neurosynaptic junction dysfunction)와 타우-단백질(tau-protein tangling), 그리고 뇌구조 등으로 바이오마크가 제시되고 있다. 이는 알츠하이머 발생의 최초 원인이 Aβ이라는 점이다. 그러나 앞서 15번 칼럼에서처럼 Kelsey R. Thomas 등의 2020년 연구에 따르면 베타 아밀로이드 프라크가 생성 이전에 인지 기능의 변화가 선행된다는 것이 확인되었으며 이는 베타 아밀로이드 프라크 생성이 알츠하이머의 최초 원인이 아니라는 것을 의미한다. 이는 치료의 최초 표적을 Aβ 이전의 발생하는 바이오마크에 표적을 둔 치료제를 개발하면 치료제로서의 효능을 더 높을 수 있다는 것을 의미한다. Aβ가 타우단백질의 신경섬유농축체(neurofibrillary tangle)보다 알츠하이머 인식장애의 최초의 원인 또는 선행하는 이론은 기전에 대한 연구가 주로 마우스를 대상으로 얻은 결과에 기인하는 것으로 추정된다. 마우스는 정상적으로는 Aβ 프라크를 형성할 수 없기에 알츠하이머 질환을 유발하지 않는다. 이에 알츠하이머 마우스 모델을 제작하기 위해서는 일련의 유전자에 돌연변이를 유발하여야 한다. 반면에 사람에게서는 알츠하이머-관련 유전자에 돌연변이가 없어도 발생한다. g즉 자연발생적으로 알츠하이머증이 될 수 없는 유전자-돌연변이 마우스 모델에서 확인된 Aβ가 알츠하이머의 최우선 원인이라 것을 사람에게도 그대로 적용하였기 때문일 것으로 추정된다.
② 알츠하이머 발병의 최초 원인으로의 타우단백질에 대한 근거: 이와 같이 마우스모델의 결과가 인체에 바로 외삽되는 현상으로 최근까지 Aβ가 알츠하이머의 원인으로 인식되어 왔다. 그러나 타우단백질 엉킴이 Aβ 프라크보다 우선하여 발생하는 것에 대한 최초의 확인은 2001년 돌연변이 타우 및 APP(amyloid precursor protein)로 형질전환 마우스 모델로부터 확인되었다(Lewis et al., 2001). 그러나 2013년 일부 환자 집단을 대상으로 한 연구에서 타우단백질이 알츠하이머 최초 원인으로 추정되기도 하였다. 알츠하이머 바이오마커에 대한 영상기술 응용과는 다르게 뇌척수액에서도 측정이 가능하다. 비록 샘플채취 시간과 채취한 샘플을 보관하는 상태에 따라 뇌의 영상기술을 이용한 바이오마커 측정뿐만 아니라 뇌척수액에서도 측정이 가능하다. 조직에서 생성된 Aβ와 타우단백질 등은 glypathic pathway를 통해 뇌척수액에서 제거도기 때문이다. <그림-4>의 붉은 원에서처럼 알츠하이머 환자 50명을 상대로 타우단백질과 Aβ를 측정한 결과, 뇌척수액(cerebrospinal fluid, CSF)에서 타우단백질(파란색 선)의 발생이 Aβ(자주색 선)를 선행한다는 것을 확인할 수 있다(Jack et al., 2013). 이는 동물에서 확인된 알츠하이머의 원인이 Aβ가 아니라는 것을 의미한다. 이어 앞서 언급한 것처럼 2020년 발표된 논문에서도 747 알츠하이머 환자를 대상으로 4년 동안 연구에서도 타우단백질이 원인으로 추정되었다.
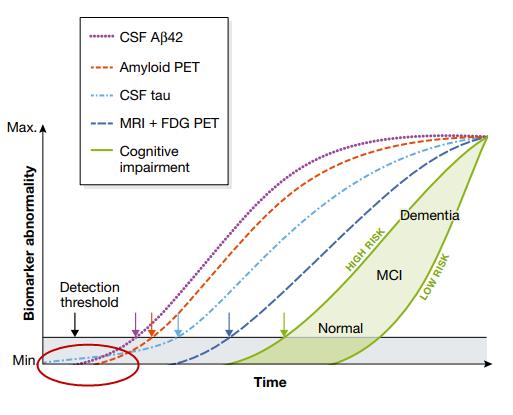
<그림-4> 알츠하이머 환자에서 선행 바이오마크: 붉은 원에서처럼 알츠하이머 환자 50명을 상대로 타우단백질과 Aβ를 측정한 결과, 뇌척수액(cerebrospinal fluid, CSF)에서 타우단백질(파란색 선)의 발생이 Aβ(자주색 선)를 선행한다는 것을 확인할 수 있다(Jack et al., 2013).
3. 알츠하이머 치료제 개발의 현황
① 개발의 현황: 현재까지 미국 식품의약국(FDA)의 승인을 받은 치매 치료제는 도네페질, 리바스티그민, 갈란타민, 메만틴 등 단 4개에 불과하다. 이 중 가장 최근에 FDA로부터 허가받은 알츠하이머 치료제는 2003년 엘러간에서 개발한 '나멘다(성분 메만틴)'가 마지막이다.
② 다국적 제약사의 개발 실패 사례: 최근에도 여러 다국적 제약사들이 알츠하이머 임상 시험을 중단했다. 2018년에는 간독성의 문제로 얀센이 개발 중이던 아타베세 스타트(개발명 JNJ-54861911)가 임상 2상 및 2·3상 시험 중단되었다. 또한, 2019년 9월 바이오젠과 에자이는 공동 개발하던 경구용 베타 세크레타제 절단효소(BACE) 억제제인 알츠하이머 치료제 후보물질 '엘렌베세스타트(개발명 E2609)' 개발이 중단되었다. 약 12억 달러, 우리 돈으로 1조 3700억 투자가 날아간 것이다. 2019년 7월 노바티스와 암젠은 알츠하이머 치료제 후보물질인 'CNP520'을 대상으로 진행중이던 임상 2·3상 시험을 중단했다. 이 외에도 화이자와 존슨앤드존슨이 공동 개발한 바피네주맙, 릴리의 솔라네주맙, 로슈의 크레네주맙도 지난해 초 임상 3상에서 효과를 인정받지 못해 임상을 중단했다. 치매 치료제 개발은 이렇게 어려운 험난한 산과 같은 장벽이 기다리고 있다(참고자료: https://blog.naver.com/bipida/222393737675)
③ 뜨거운 감자 - 아두카누맙(aducanumab): 미국 식품의약국(FDA)은 2021년 6월 7일(현지시간) 시판 후 효능·안전성을 확인하는 임상 4상을 조건으로 미국 바이오젠·일본 에자이가 개발한 알츠하이머 치료제 ‘아두카누맙’을 승인했다고 밝혔다. FDA가 알츠하이머 관련 치료제를 승인한 것은 2003년 이후 약 18년 만이다. 기존 치료제들이 기억력 감소 등 일부 증상에 효과가 있었다면, 질환 자체를 타깃으로 한 치료제 승인은 이번이 처음이다 (참고자료: https://news.v.daum.net/v/20210608140303802) . 아두카누맙은 단항체(Monoclonal Ab)로 Aβ의 3-6번째 아미노산에 결합한다. Aβ의 단일체에는 붙지 않고 프라크 구조를 인지 및 결합을 통해 뭉쳐진 플라크를 수용성으로 전환시켜 녹여낸다. 그러나 일부 전문가들은 이번 승인에 대해 반대 의견을 제기하고 있다. 치료 기간과 약물 투여 중단 결정기준, 치매 진행 정도에 따른 효과 등이 충분히 검증되지 않았음에도 FDA가 전문가 의견을 무시한 채 승인을 강행했다는 지적이다. 미국 국립노화연구소 리처드 박사는 “아밀로이드를 제거하는 것이 중요한 것은 맞지만, 유일한 기여 요인은 아니다”며 “이번 승인이 최종 답안이라고 볼 수 없다”고 말했다. 이밖에 높은 가격도 문제점으로 지적된다. 아두카누맙의 1회 투약 비용은 약 4312달러(한화 480만원)로, 연간 투약 비용은 약 5만6000달러(한화 6242만원)에 달한다. 이와 같은 다양한 이유로 미국 식품의약국(FDA) 산하 자문위원회의 일부 전문가들이 자문직을 그만뒀다. FDA가 자문단의 의견을 무시하고 아두카누맙을 승인한 것에 대한 반발이다. 아두카누맙 판매 승인 건에 대해 자문위원 11명 중 10명은 이 약물이 인지 저하를 늦출 수 있다는 증거가 불충분하다는 의견을 냈다. 나머지 1명 또한 확실하지 않다는 의견을 제시했다. 사실상 자문위원회 11명 전원이 아두카누맙 승인에 반대표를 던진 것이다. 하지만 FDA는 지난 2021년 6월 7일 아두카누맙의 판매를 승인했다. 이와 같은 논란 핵심은 Aβ가 제거가 되어도 알츠하이머 환자의 인지기능 장애가 개선이 되지 않는다는 점이다. 또한 항체 자체가 뇌에 들어가 생기는 독성으로 인한 뇌출혈이나 뇌가 붓는 현상(brain swelling)으로 심지어는 사망에 이르는 부작용이 나타났다. 이와 같이 지금까지 Aβ를 겨냥하는 항체들이 오랫동안 수모를 겪는 임상실패의 결정적인 이유는 기억력 감퇴에 효과가 없거나 인지기능 개선이 없었기 때문이다. 단지 개발된 알츠하이머 치료제는 치매의 진행을 막을 수는 없지만 진행을 늦추는 데 중점을 두고 고안됐다. 플라크 제거 역할(Plaque-Busting Power)과 뇌기능과는 관련이 없다는 점이 문제가 된다.
