11. PK 및 TK에서 기타 고려 요소
1) 독성시험과 TK 시험
○ TK는 독성시험의 용량군과 동일하게 설정되어야 혈장농도에 따른 독성의 반응을 비교할 수 있다. 따라서 반복투여독성시험, 생식발생독성시험과 발암성시험 등을 비롯하여 대부분의 동물을 이용하는 독성시험과 함께 수행이 가능하며 이와 같이 본시험과 함께 수행되는 TK를 concomitant TK(독성시험-동시 수행 TK)이라고 한다, 독성시험에서 용량군의 모든 동물을 대상으로 수행할 수도 있지만 용량군 중에서 3 마리 정도를 선정하여 수행하는 군의 개체를 representative subgroup(대표 소군)이라고 한다. 또한 독성시험과 별개로 유사한 조건에서 TK 시험목적으로 수행하기 위한 동물군을 satellite group(위성군)이라고 하며 암수 3마리정도를 두며 예시와 같이 수행할 수 있다.
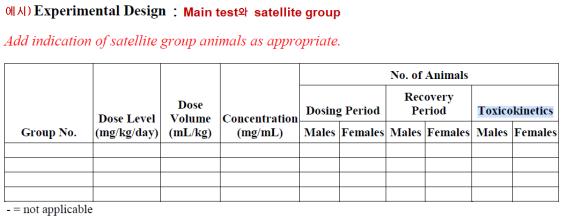
2) 채혈의 time point 및 횟수
○ 혈액의 10% 이하로 생리학적 스트레스가 유발하지 않도록 채혈한다.
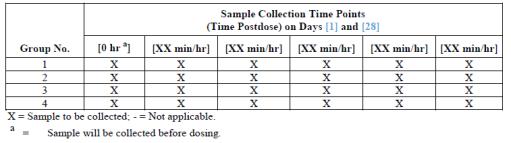
○ TK의 채혈 time point는 다양한 앞선 시험을 통해 선택할 수 있지만 원물질만 측정할 경우에는 투여 후 0.5, 1.0, 2.0, 4.0, 8.0, 12.0 와 24.0 등의 7 point를 기준으로 수행할 수 있다. 일반적으로 30분에서 1시간 사이에 흡수가 대부분이 이루어지는데 흡수, 혈장 최고 농도, 그리고 배설 등의 각 phase 특성에 따라 보다 정확한 파악을 위해 채혈 time point를 추가할 수 있다. 기타 선행 시험을 통해 개략적 time point 및 횟수를 결정하는 것이 바람직하다.
○ 설치류: 혈액량은 설치류에서 0.25-0.50 ml/day으로 추천되는데 TK만을 위한 satellite group에서는 time point 당 200 μl의 교차채혈이 전형적으로 이루어진다.
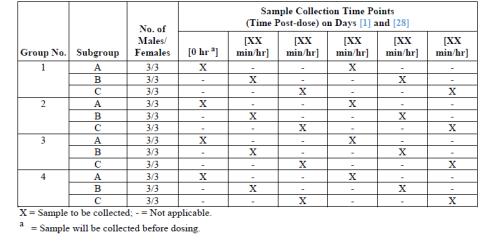
○ Dog, Monkey 등의 비설치류: 비설치류는 교차채혈이 없이 1 ml/day로 채혈이 이루어지고 있다.
3) Microsampling(초미량 채혈)
○ ICH(2018): S3A Guidance: Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposure in Toxicity Studies: Focus on Microsampling의 guideline 통해 동물실험에 대한 일반적 원칙인 3R 원칙(replacement, reduction, refinement)을 강조하기 위해 합성의약물뿐만 아니라 바이오의약품에 대한 TK 시험 및 분포시험에서 microsampling(초미량 채혈)이 2018년에 제시되었다. 이는 아래의 <그림>에서처럼 동물의 희생을 최소화하기 위해 satellite group을 이용하는 TK 시험을 본시험에서 동시 수행하는 concomitant TK 시험으로 대체하기 위함이다. 따라서 본시험에서 3마리의 representative subgroup(대표 아군) 을 설정하여 TK 시험을 투여 후 1일차와 28일차에 수행하게 된다. 여기서 microsampling을 위한 채혈 용량은 50μl 이하 를 의미한다. 이는Satellite group을 이용한 채혈 200 μl의 4배 정도 낮은 채혈용량이다. Microsampling 을 이용하며 최소한 20 %에서 최대한 55 %까지 동물의 희생을 줄을 수 있다.

<그림> Satellite group을 대신하여 concomitant TK 시험을 통한 동물 희생의 감소율
○ Microsampling에 의한 TK 신뢰성: 그러나 Microsampling이 물질 및 분석기기에 따라 정량 한계 이하(Below the Limit of Quantification, BLQ), 정량 최소한계(Lower Limit of Quantitation, LLOQ) 또는 검출한계(detection limit)에 의해 보증할 수는 없다. BLQ란 설정된 분석절차로 신뢰성이 있게 분석할 수 있는 가장 낮은 분석물질 농도 이하를 의미한다.
○ Microsampling의 한계점: TK와 PK의 parameter 산출을 위해 활성형 물질 또는 원물질만 측정의 대상이지만 임상시험에서 채혈의 목적과 동일하기 위해 혈장, 혈청 그리고 혈액 전체 등 분석의 대상이 PK 및 TK 시험마다 다를 수 있다. 때로는 임상시험에서 혈구세포를 포함한 혈액학적 지표(hematological parameters), 약물의 혈장단백질의 결합비(plasma protein binding ratio), 그리고 약물의 혈액(blood)/혈장(plasma) 또는 혈청(serum)의 비(blood/plasma or serum ratio of the drug) 등을 확인하기 위해서 microsampling로는 한계가 있을 수 있다
4) TK 시험에서 약물의 대사체 확인의 필요성이 요구되는 경우
○ 일반적으로 전신 노출 또는 독성 영향을 확인하기 위해서는 원물질(parent compound)의 약물농도가 우선적으로 측정 또는 고려된다. 그러나 때로는 PK 및 TK 시험에서 다음 같이 3가지 경우에는 혈장이나 체액에서 대사체에 대한 농도 측정이 이루어진다.
① 약물 전구체(프로드러그, precursor, pro-drug) 또는 대사 후 약효 약물(pro-drug):
Pro-drug은 그 자체가 약효가 없지만 흡수되어 우리 몸 안에서 대사되어 구조가 변하게 되면 효과가 나타나는 약물이다. 이러한 경우에 원물질 약물만 혈장에서 측정하게 되어 pro-drug의 대사체 농도에 의한 over dose로 과잉 약리작용-유도성 독성이 제외된다. 따라서 TK 시험을 통해 독성과 관련된 여러 지표가 올바르게 추정할 수 없게 된다. 이와 같은 단점에도 불구하고 Prodrug 을 사용하는 이유는 1) 약물의 물리적 특성 변형 혹은 약동학적 특성, 2) 약물 자체에 독성이 나타나는 경우 독성을 수정(masking), 3) 특정한 조직 혹은 세포에서만 변화되어 특이적 약물 전달 등이다. Prodrug은 원물질에 에스터(ester)나 인산(phosphate)을 결합하여 가수분해(hydrolysis) 하는 형식으로 합성된다.
② 원물질 및 대사체의 약리작용 및 독성작용 약물: 원물질도 약리 작용 및 독성 작용도 하지만 대사체도 약리 작용 및 독성 작용이 가능한 약물
③ 빠른 대사의 특성을 가진 약물: 약물이 체내에서 너무 빨리 대사되는 경우에 PK 및 TK 시험에서 원물질의 혈장농도에 대한 측정이 불가능하다. 이러한 경우, 혈장에서 대사체 측정으로 PK 및 TK에 의한 지표를 추정할 수 있다.
12. 다종약물치료법(MDT-Multi Drug Therapy)에 의한 kinetics의 변화와 독성(toxicity)
1) 다종약물치료와 pharmacokinetic interaction
○ 기존의 약물을 두종 이상을 동시에 투여하여 새로운 적응증에 응용하거나 기존 약물의 치료 효과를 높이기 위해 여러 약물을 동시에 투여하는 약물치료법을 다종약물치료법(MDT-Multi Drug Therapy, cocktail therapy, combination therapy)이라고 한다. <그림>은 Drug A가 다른 약물과 다중약물치료법에 의해 약물동태학의 변화를 나타난 것이다. 이와 같이 다중약물치료법에 의해 주약물(object drug)이 촉진약물(precipitant drug)로 동태학적으로 변화하는 것을 pharmacokinetic interaction이라고 한다
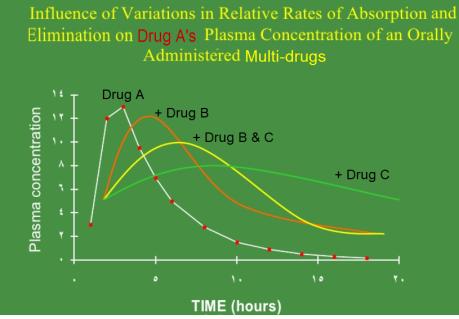
<그림> Drug A가 다른 약물과 다중약물치료법에 의해 약물동태학의 변화
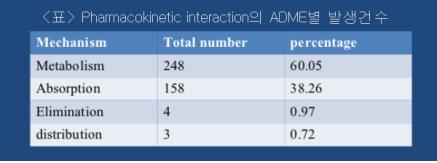
○ Pharmacokinetic interaction의 역학적 특징: 환자 116명에게 567 종류의 처방전을 통해 413건의 p harmacokinetic interaction이 확인되었다. <표>는 ADME 별 Pharmacokinetic interaction 건수를 나타낸 것으로 metabolism에 의한 영향이 60.05%로 가장 높았고 다음으로 경구 흡수에 대한 영향이 38.26%로 두 번째로 높았다. 이와 같이 다중약물처방에 의해 pharmacokinetic interaction이 발생하여 약물의 동태학적 영향을 유발하지만 또한 약력학적(pharmacodynamic) 및 독성학적 영향도 유발한다. 이와 같이 다중 약물처방에 의해 체내에서 약물의 약리학적 및 독성학적 변화를 유도하는 것을 약물-약물 상호작용(drug-drug interaction, DDI)이라고 한다.
2) 다중약물처방에 의한 대사 측면의 이해 - 약물상호작용과 cytochrome P450
① Cytochrome P450에 의한 약물-약물 상호작용: 일반적으로 효소는 2가지 종류인 구성효소(constitutive enzyme)와 유도효소(inducible enzyme)로 구분된다. 구성효소는 외부 기질 및 유도물질의 노출에 상관없이 항상 일정하게 체내에 존재하는 효소이며 유도효소는 유도물질의 노출에 의한 발현이 증가가 되는 효소이다. Cytochrome P450 (약칭 CYP) 의 독물-약물대사효소군은 약물 또는 외인성물질 노출로 유도되는 효소들이며 노출 후 6시간, 늦으면 2 주 후 정도의 시간이 지나서 유도가 이루어진다. 이와 같이 단일 약물이 아닌 여러 약물 또는 외인성물질의 동시 노출로 약물의 상호 간 영향을 주는 작용을 약물-약물 상호작용( drug-drug interaction, DDI)이라고 한다. 약물 및 외인성물질은 CYP의 기질뿐만 아니라 CYP의 저해물질 (inhibitor) 또는 유도물질 (inducer) 도 될 수 있다. <그림>은 A와 B의 약물이 각각의 CYP에 대해 기질 그리고 상대 CYP에 대한 저해제 또는 유도물질로 작용할 때 다음과 같이 3가지 기전인 (1) CYP 저해 및 유도를 통한 혈중약물 감소와 증가에 의한 과잉 및 저하의 약리작용, (2) CYP 저해 및 유도에 의한 약물의 대사 지연 또는 빠른 배출에 의한 약효감소 및 과잉 약리작용, (3) CYP 유도에 의한 초기반응자 생성의 감소 및 증가 상호작용의 결과에 의한 독성 변 화 등이 유 도된다. 초기반응자(chemical initiator)란 자연분해 및 생화학적 전환(biotransformation)에 의한 친전자성 전환체 또는 대사체로 친핵성 4대 거대분자와 결합하여 독성을 유도하는 원물질의 전환체이다. 과잉용량과 약효감소는 복용량의 조절로 어느 정도 부작용을 예방할 수 있지만 초기반응자는 효소 활성의 변화 및 DNA 손상을 빠르게 유도하기 때문에 DDI의 독성학적 측면에서 가장 중요한 요소라고 할 수 있다.
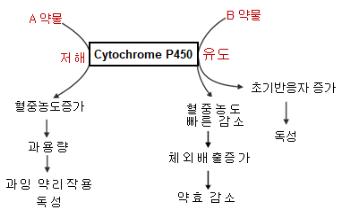
<그림> 약물-약물 상호작용을 통한 다양한 영향: A와 B의 약물이 각각의 CYP에 대해 기질 그리고 상대 CYP에 대한 저해제 또는 유도물질 유도의 기능을 한다면 다음의 3가지 기전인 ① CYP 저해 및 유도를 통한 혈중약물 감소와 증가에 의한 과잉 및 저하의 약리작용, ② CYP 저해 및 유도에 의한 약물의 대사 지연 또는 빠른 배출에 의한 약효감소 및 과잉 약리작용, ③ CYP 유도에 의한 초기반응기 생성의 감소 및 증가 상호작용의 결과에 의한 독성 변화 등이 유도된다.
② 약물-약물 상호작용의 다양한 형태와 CYP 측면에서의 해석: 약물 2종류가 동시에 노출되었을 때 개체 내에서는 약물상호작용이 나타날 수 있으며 아래의 <표>에서처럼 상호작용에 의한 독성이 증가할 수도 감소할 수도 있다. 각각 물질에 대한 개체에 대한 기대 독성이 한 개체에 동시에 노출되었을 때 독성의 합으로 나타나는 독성의 경우에 부가작용 (additivity) 이라고 한다. 화학물질의 독성이 독성을 가진 다른 화학물질에 의해 전체 독성이 감소하는 경우에 길항작용 (antagonism) 이라고 한다. 독성이 안 나타난 화학물질이 다른 화학물질의 노출로 인하여 독성의 합이 개별 독성보다 큰 독성이 유도되는 기전을 강화작용 (potentiation) 이라고 한다. 화학물질의 개별 독성의 합이 동시에 노출되었을 때 합보다 크게 나타나는 독성의 경우에 상승작용 (synergism) 이라고 한다. 그리고 두 물질이 CYP에 의한 생화학적 전환에 의존하는 간접작용-독성물질이라는 조건으로 <표>에서의 약물-약물 상호작용의 다양한 형태에 대한 CYP 측면에서 해석이 이루어졌다. 인체의 대부분 약물은 간접작용-화학물질을 원물질로 한다. 이는 직접작용-화학물질 경우에 인체에 접촉과 동시에 자연분해에 의한 초기반응자의 빠른 생성으로 복용과 동시에 부작용이 유발 되기 때문이다. 부가작용의 경우에 약물의 개별 독성의 합이 같아 각각의 초기반응자를 생성하지만, 각각의 CYP에 대한 유도물질 또는 저해제 역할을 하지 않은 것으로 추정된다. 길항작용의 경우에 두 약물의 독성 합이 감소의 작용인데 이는 초기반응자의 생성 억제에 의한 독성 감소에 기인하다. 또한 두 약물 또는 개별 약물이 CYP에 대한 저해제 역할을 한 것으로 추정된다. 강화작용은 독성이 없는 약물이 존재함으로 초기반응자 생성이 없는 약물과 초기반응자를 생성하는 약물의 상호작용 결과이다. 약물 A가 약물 B의 CYP에 대한 유도물질 작용으로 약물 B의 초기반응자가 혼합 후 더 큰 규모의 독성이 유발되었다. 상승작용은 두 약물 모두 초기반응자를 생성하며 각각의 CYP에 대한 유도물질 역할을 통해 더 많은 초기반응자의 생성으로 합보다 더 큰 독성이 유발되었다. <표> 독성뿐만 아니라 약물의 다중약물처방의 DDI 의한 약효 변화 측면에서 부가작용, 길항작용, 강화작용 그리고 상승작용으로 설명이 된다
<표> 두 가지 약물의 상호작용에 의한 독성 강도의 변화와 CYP 측면의 해석
| 상호작용의 형태 | 독성작용 약물 A | 독성작용 약물 B | 혼합작용 약물 A+B |
| 부가작용(additivity) | 20% | 30% | 50% |
| CYP 측면의 해석 | 약물의 A와 B는 각각의 초기반응자를 생성하는 CYP에 대한 유도물질 또는 저해제 역할을 서로 하지 않음. 즉 각각의 약물은 각각의 CYP에 대한 기질 역할만 함. 이에 초기반응자의 생성 정도에 비례적으로 독성을 유발함. | ||
| 길항작용(antagonism) | 20% | 30% | 5% |
| CYP 측면의 해석 | 두 약물은 각각의 초기반응자를 생성하는 약물이면서 각각 다른 개별 CYP에 대해 상호 활성 저해제 역할. | ||
| 강화작용(potentiation) | 0% | 20% | 50% |
| CYP 측면의 해석 | 약물 A는 CYP에 의해 초기반응자로 전환되지 않는 무독성대사체 생성하는 약물이며 약물 B는 CYP에 의해 초기반응자로 전환되는 약물. 약물 A는 약물 B의 CYP를 유도물질로 활성을 촉진하여 혼합 시 약물 B의 더 많은 초기반응자 생성으로 독성 증가. | ||
| 상승작용(synergism) | 5% | 10% | 100% |
| CYP 측면의 해석 | 두 약물은 각각 CYP에 의해 초기반응자가 생성되며 동시 둘 중 하나 또는 둘 모두 각각의 CYP에 대한 유도물질 역할을 수행. | ||