○ 인간의 세계관을 논하는 철학의 한 분야에서 우리는 어떻게 지식을 쌓고 세상 현상을 어떻게 이해하는 가에 대한 인식론은 끊임없는 변화와 새로운 이론이 제시되어 왔다. 철학사에서 인식론의 출발은 소크라테스의 대화법일 것이다. 길거리의 광장을 비롯하여 잔칫집 등에서 시민과 문답을 통해 무지를 깨닫게 하다 결국 현혹과 사회혼란 죄로 사형을 당한다. 그의 죽음은 아테네 사상의 찬란한 빛을 발하는 플라톤과 아리스토텔레스와 같은 걸출한 철학자가 배출되는 계기가 되었다. 개인적으로는 이들 철학자들을 배출하게 된 배경에는 솔론의 존재라고 생각한다. 솔론은 시민들의 합의에 의해 정책이 결정되는 정치 개혁을 하였고 이는 활발한 토론을 유도하였다. 소크라테스의 대화법도 이를 배경으로 출발하게 되었기에 솔론의 정치개혁은 철학사에서 끼친 영향 측면에서 실로 위대하다고 할 수 있다. 소크라테스의 인식론에서 삶의 방향은 정신에 의해 결정된다고 주장하듯 정신이 인식의 주체가 된다. 특히 소크라테스는 육체-정신(영혼)의 분리가 된 심신이원론적 입장이다. 소크라테스에 의하면 육체는 객관적으로 존재하지만 그저 껍데기일 뿐이고 지식은 영혼 안에 내재된 개념으로 육체와 정신을 분리하여 인식하였다. 이는 대부분의 종교에서도 그렇다. 또한 근대철학의 출발점인 데카르트의 ‘나는 생각한다, 고로 존재하다’에서처럼 ‘사유하는 나’ 즉, 인식의 주체가 정신이었다. 이는 인식에 있어서 정신이 신체보다 앞선다는 것이다. 또한 데카르트는 시각에 대해서 정신적인 눈으로 정의하고 정신적인 눈은 자신의 신체마저도 바깥 세상의 사물들처럼 볼 수 있다고 생각하는 것이다. 이 역시 관념적인 것으로 심신이원론으로 이해되었다. 즉, 정신적인 눈은 결국 철학 및 인식에 있어서 신체와 분리된 정신 즉 머리로의 사유가 주체가 된다 것을 의미한다. 아마 철학사에서 10대 철학자로 선택될 수 있는 프랑스의 메를로 퐁티(Maurice Merleau-Ponty)는 1945년 <지각 현상학>을 통해 살(신체)의 인식론 또는 살의 철학으로 기존의 철학적 체계를 허물게 된다. 그는 시각을 신체의 눈으로 정의하면서 인간은 신체의 감각을 통해 지각하고, 이로부터 세상의 현상을 인식하게 된다고 주장하였다. 이는 곧 인식의 주체가 단순히 정신만 아니고 실존이라는 바탕 하에 동일한 연속선상에 존재 및 상호연관성으로 정신과 육체의 일원론이라는 점이다. 몸이 체험하는 것이 곧 지각이고 정신보다 앞선다는 것이다. 예를 들어 서구의 인사법에서 볼을 서로 비비는데 이러한 신체의 접촉 및 지각을 통해 정감이라는 의식이 발생하는 것이다. 이는 신체 또는 살이 모든 인식의 선험적 조건이며 우리를 세계로 연결하는 지향적 단서라는 것이다.
즉, 우리의 몸, 신체 또는 살이라는 간격을 통해서만 세상과 연결과 된다는 것이다. 더 이상 몸은 정신과 분리되어 정신에 의한 인식의 객체가 아니라 마치 중추신경계와 말초신경계가 연결되어 있듯이 정신과 연결되어 인식의 주체라는 것이다. 이러한 측면에서 어쩌면 몸들 둘러싸고 있는 피부는 세상에 대한 인식에 있어서 최전방에 놓여 있다는 측면을 이해한다면 피부질환에 대한 해결은 사람의 세계관을 바꾸는 도구가 될 정도로 중요하다. 이와 같은 마음으로 (주)켐온은 생명과 사람 중심의 가치관으로 시험하고 공부하고 늘 노력하고 있습니다.
○ 지난 칼럼에서는 아토피피부염과 아토피의 차이점을 논하였다. 즉 다른 사람들에게는 별로 해가 없는 외부물질(항원)에 대한 신체의 과민반응을 알레르기(allergy)이라고 하며 atopy(또는 atopic syndrome)는 고알레르기성(hyperallergic) 특성에 유발되는 증후군이다. Atopy를 가진 환자라고 함은 아토피성 피부염(atopic dermatitis, AD), 아토피성 천식, 아토피성 비염(allergic rhinitis), 알레르기성 결막염(conjunctivitis) 중에서 1-2개 질환을 가진 환자를 의미한다. 따라서 아토피피부염은 아토피의 여러 질환 중의 하나이다. 다음은 아토피피부염의 세포학적 및 분자학적 기전에 대한 내용이다.
1) 아토피피부염에 있어서 선천성면역 vs 후천성면역
○ 선천성면역 vs 후천성면역: 아토피피부염의 병인론 측면에서 선천성면역과 후천성면역 모두 중요한 역할을 한다. 일반적으로 면역은 출생과 발생 양상에 따라 크게 2 가지 종류인 선천성면역(innate immunity, 자연면역, 능동면역, 항원-비특이적 면역)과 후천성면역(acquired immunity, 획득면역, 수동면역, 항원-특이적 면역, 적응면역)으로 구분된다. 선천성면역은 출생과 더불어 발생하는 면역으로 병원균을 제거하여 감염을 예방하는 초기 면역반응이다. 선천성면역은 거의 모든 외부 항원에 대해 생체에서 수 시간이내에 즉각적으로 발생하는 항원-비특이적 면역반응이다. 항원-비특이적 반응이란 항원에 대해 기억작용이 없는 면역반응을 의미한다. 선천성 면역반응의 예로는 균을 잡아먹는 식세포(phagocyte; 일반적으로 대식세포와 이보다 작은 식세포인 과립성 백혈구)에 의한 면역반응이 있다. 선천성 면역반응에서는 표피의 랑게르한스세포(Langerhans cell), 수지상세포(plasmacytoid dendritic cell), 혈액에 존재하며 면역반응이 요구되는 부위에 응집하는 자연살해T세포, 단핵구와 과립구 등의 면역세포가 중요한 역할을 한다. 반면에 후천성면역은 항원을 기억하는 특이적 면역반응으로 적어도 수일간에 걸쳐 발생한다. 항원에 대해 항체가 형성되면 동일한 항원에 대해 일생에 걸쳐 획득하는 획득면역이다. 후천성면역에서는 수지상 세포를 비롯하여 T-세포, B-세포 등이 주요한 역할을 하며 이들 세포로부터 수많은 사이토카인과 케모킨과 같은 매개물질에 의해 면역반응이 수행된다. 후천성면역인 경우에는 체액성면역반응(humoral immunity)과 세포-매개 또는 세포성면역반응(cell-mediated immunity)으로 구분된다. 체액성면역반응은 침입한 항원에 대한 항원-특이적 항체 생성을 통해 면역반응이 이루어지므로 세포와는 독립적으로 항원에 대한 면역반응이다. 체액성면역반응은 항체를 생성하는 B-세포에 의해 주로 수행된다. 세포-매개 면역반응은 세포가 직접 항원을 제거하는 경우를 의미하는데 종양세포에 대한 면역반응이나 바이러스에 감염된 세포에 대한 면역반응이 있으며 T-세포이나 자연살해T-세포에 의해 수행된다.
○ Th1 및 Th2세포 불균형: 아토피피부염 환자는 외형적으로 선천성면역에 결함이 있어 바이러스, 박테리아와 진균의 병원체의 감염에 높은 감수성을 보이는데 이러한 감수성은 피부군체형성시험(Skin Colonization test)을 통해 확인할 수 있다. 피부군체형성시험은 특정 균을 피부에 도포 후 균이 생존하여 군체를 어느 비율로 형성하는가를 확인하는 시험이다. 황색포도상구균( Staphylococcus aureus )에 대한 피부군체형성시험에서 정상인 경우에는 5% 정도가 군체가 형성되지만 아토피피부염 환자에서는 약 90%가 군체가 형성되었다. 이는 병원균에 대한 대식세포의 역할 즉 선천성면역이 그 만큼 약하다는 것을 의미한다. 또한 후천성면역의 특성도 아토피피부염 환자에서 변화된다. 일반적으로 Th1세포(helper type1 T cell, 제1형 보조 T 세포)는 세포-매개 면역반응, Th2세포(helper type2 T cell, 제2형 보조 T 세포)는 체액성 면역반응을 촉진시킨다. 정상적인 상황에서 Th1세포와 Th2세포는 상호억제조절을 통해 균형을 유지한다. 그러나 특정 질환에서는 Th1에서 유래한 사이토카인과 Th2에서 유래한 사이토카인 간의 불균형으로 면역반응의 불균형을 가져올 수 있다. Th1과 Th2 면역체계가 불균형이 이루어지면 인체는 즉각적으로 질환이 발생된다. 예를 들어 Th2세포보다 Th1세포가 지나치게 활성화되면 류머티스 관절염이나 제1형 당뇨와 같은 질병이 발생하며 Th1보다 Th2 면역체계가 활성화되면 아토피피부염과 같은 각종 염증반응을 동반한 면역과민반응이 발생한다. 특히 아토피피부염의 발생기에서 Th2세포-지배적 환경이 초래되어 피부염의 병변을 유도, 만성병기에서는 Th1세포-지배적 환경이 유도된다. 따라서 면역학적 측면에서 아토피피부염의 특성은 선천성면역의 약화되며 후천성면역의 Th1 및 Th2세포 불균형으로 정의할 수 있다.
2) 아토피피부염에 있어서 즉시형 과민반응 vs 지연형 과민반응
○ 즉시형 과민반응 vs 지연형 과민반응의 특성: 아토피피부염은 atopy의 일종이며 atopy는 알레르기 반응에 의해 유발되는 증후군이다. 알레르기 반응이란 일단 항원에 감작된 개체가 재감작되면서 이미 만들어져 있는 항체와 2차적으로 면역반응이 일어나는 경우를 말하며 과민반응(hypersensitivity)이라고 한다. 과민반응은 발생속도 및 면역반응의 강도에 따라 즉시형 과민반응(immediate-type hypersensitivity)과 지연형 과민반응(delayed-type hypersensitivity)으로 구분된다. 즉시형 과민반응은 신속하면서 강한 면역반응으로 체액성 면역의 특성이며 반면에 지연형 과민반응은 약하면서 다소 느린 면역반응으로 세포-매개 면역반응이 이에 속한다. 또한 즉시형 과만반응은 아래의 <표-1>에서처럼 Type I-III, 지연형 과민반응은 Type IV가 있다.
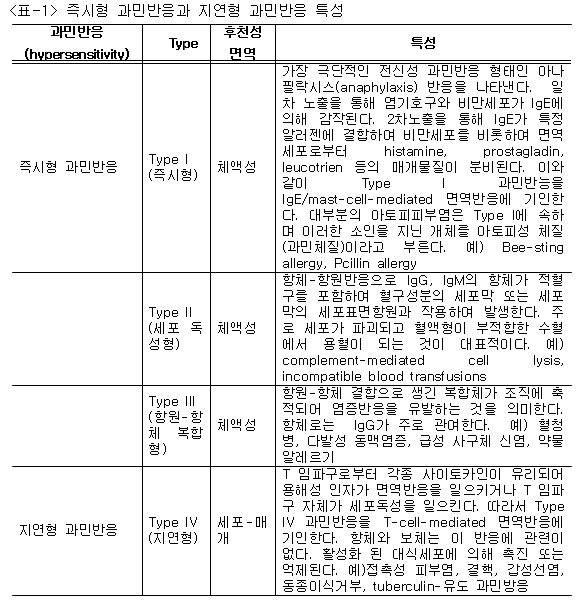
○ 아토피피부염의 과민반응: 아토피피부염은 즉시형 과민반응의 Type I로 알려졌으나 증상 유발에 있어서 지연형 과민반응인 Type 4도 관련이 있는 것으로 확인되고 있다. 일반적으로 즉시형 과민반응의 Type I 반응은 피부단자시험(skin prick test), 지연형 과민반응의 Type II는 피부첩포검사(skin patch test)를 통해 확인된다. 진드기 항원을 이용한 피부단자시험을 통해 아토피피부염 환자 중 20-60% 정도가 즉시형 과민반응이 나타나는 것으로 확인되었다. 피부첩포검사를 통해 아토피피부염의 환자 중 30-50%가 지연형 과민반응이 나타나는 것으로 확인되었다. 이러한 검사를 통한 과민반응 확인이 아니더라도 아토피피부염 환자에서 병원균에 감수성이 높다는 측면과 Th1세와 Th2세포의 불균형이라는 측면에서 즉시형 및 지연형 과민반응 모두 중요한 역할을 하는 것으로 추정된다.
3) 아토피피부염의 세포학적 및 분자학적 기전
○ 이와 같이 아토피피부염은 과민반응의 결과이며 이는 면역세포의 활성과 밀접한 관계가 있다. 특히 아토피피부염와 관련된 면역세포 중 T-세포와 비만세포는 증상을 유발하는데 있어서 중요한 세포이기 때문에 이들의 역할에 대한 이해는 중요하다.
① T-세포: 아토피피부염은 면역학적 측면에서 Th2세포와 Th1세포의 활성의 변화에 기인하며 이러한 변화는 아토피피부염의 진행에 따라 나타나게 된다. 따라서 아토피피부염에 대한 이해는 다른 어떤 면역세포보다 T-세포에 대한 이해가 필요하다. 백혈구의 일종인 T-세포(T cell, T임파구)는 골수-유래의 줄기세포(stem cell)에서 분화되어 흉선(thymus, T-세포의 명칭 유래)에서 성숙한다. T-세포는 역할에 따라 T1세포(기억 또는 T-세포, memory 또는 delayed T cell, 항원이 들어오면 즉시 반응력 있는 다른 세포로 전환), T2세포(Killer T cell, 살해T-세포, 직접 항원을 죽일 수 있는 독성물질을 방출하여 항원파괴), T8세포(suppressor T cell, 억제T-세포 또는 regulatory T cell, 조절T-세포, 세포성 및 체액성 면역을 적절한 시기에 종식시킴), T4세포 또는 Th세포(Helper T cell, 보조T임파구, B cell에 작용하여 면역을 촉진하며 대식세포 활동을 조절하고 interleukinⅡ를 방출)로 구분된다. Th세포는 IL-2에 의해 Th0(T helper 0)로 분화하며 사이토카인에 자극받아 Th1(helper type1 T cell)과 Th2(helper type2 T cell)로 분화된다. Th세포가 환경에 의해 Th1세포와 Th2세포로 각각 분화되는 것을 분극(polarization)이라고 하며 이들 분극화된 세포에서 분비되는 사이토카인을 분극화된 사이토카인(polarized cytokine)이라고 한다.
Th1세포와 Th2세포의 분극은 T-세포 막표면의 CD4+(cluster of differentiation 4+)라는 당단백질의 자극을 통해 이루어진다.
CD 분자의 +, -부호는 특정 CD 분자 유무를 의미한다. 예를 들면 CD34+와 CD31 -세포는 각각 CD34가 존재하고 CD31 없다는 것을 나타낸다.
Th1세포와 Th2세포의 균형을 위한 면역조절은 사이토카인 분비를 통해 이루어진다. Th1세포는 IFN-γ , IL-2, TNF-β의 분비하며 Th2세포는 Interleukin-4(IL-4), IL-5, IL-10 그리고 IL-13의 분비를 촉진시킨다. Th1세포의 사이토카인은 대식세포-의존성 면역반응, Th2세포의 사이토카인은 B-세포의 활성을 통해 포함한 강력한 항체 반응을 유도한다. 특히 Th2세포에서 분비된 IL-4, IL-10, IL-13은 Th0에서 Th1로의 분극을 저해하는 면역조절을 한다. 반면에 Th1세포에서 분비되는 INF-γ는 Th2세포의 사이토카인 분비를 억제하여 Th1/Th2의 균형을 조절한다.
이와 같이 T-세포는 분화를 통해 Th1세포와 Th2세포로 전환되는데 이는 아토피피부염의 발병 및 진행과 밀접한 관계가 있다. 면역학적 측면에서 아토피피부염은 장기간에 걸쳐 진행되면서 재발생을 가진 소양성 면역피부질환으로 규정된다. 또한 아토피피부염의 특징은 피부염증, 피부장벽 손상에 의한 기능 저하, IgE-매개 감작(IgE-mediated sensitization)이다. 아토피피부염의 원인에 대해서는 아직 완벽하게 규명되지 않았지만 일반적으로 유전자 요인과 환경요인의 복잡한 상호작용에 의한 과민반응에 인하는 것으로 추정되고 있으며 다음과 같이 2가지 병인론으로 설명되고 있다.
○ 질환의 일차 원인으로 피부장벽의 기능에 있어서 내인성(intrinsic) 또는 유전적 결함
○ Th2세포-유도 염증과 IgE-매개 감작을 유발하는 면역장애
첫 번째 가설은 아토피피부염의 발병기와 관계가 있으며 두 번째 가설은 아토피피부염의 진행과정과 관계가 있다. 아토피피부염 발생 및 진행은 면역학적 특징에 따라 발병기(onset), 급성병기(acute phase) 그리고 만성병기(chronic phase)로 구분되어 설명된다. 이러한 시기 구별은 피부장벽의 기능, 병변의 특성, 그리고 세포 및 사이토카인의 활성에 기초하여 이루어진다. 첫 번째 병인론에서처럼 아토피피부염의 시작은 피부장벽의 비정상적인 기능에 기인한다. 피부장벽이 선천적 또는 내재적으로 문제가 있는 사람은 주변 환경의 알러젠에 쉽게 노출될 수 있기 때문에 잠재적으로 아토피피부염에 걸릴 가능성 있는 사람이다. 따라서 아토피피부염의 발병기는 알러젠이 기능이 약한 피부장벽을 통해 피부내부로 침입으로 시작된다. <그림-1>의 A)에서처럼 알러젠은 손상된 피부장벽을 통해 랑게르한스세포에 결합하면 항원전달세포(antigen-presenting cell)인 표피수지상세포(dermal dendritic cell)로 성숙한다. 이러한 이유로 피부와 점막조직에 있는 수지상세포를 랑게르한스세포로 혼용되어 불리며 동일한 세포이다. 이들 알러젠이 결합된 항원전달세포는 더 이상의 항원이 결합하는 능력을 상실하고 항원-전달 능력을 얻게 되는 성숙의 과정을 통해 임파절(lymph node)로 이동한다. 이동한 항원전달세포는 미분화 T-세포(native T-cell)인 Th0세포를 Th2세포로의 분화를 촉진하여 알러젠이 침투한 부위에서 Th2세포 활성이 지배적인 환경을 만들게 된다. 결과적으로 Th2세포는 B-세포를 자극하여 IgE 생성 및 분비를 촉진한다. 생성된 IgE는 비만세포(mast cell)를 비롯하여 호산구 등의 면역세포 활성을 유도하여 피부조직 침윤과 염증반응을 통해 피부장벽의 손상을 더욱 악화시킨다.
아토피피부염의 급성병기에서는 습진성 피부병변이 특징이다. 습진성 병소는 Th2세포 의 침윤, 그리고 이들 세포로부터 분비되는 사이토카인과 케모킨, 알러젠-IgE가 결합한 랑게르한스세포에 기인한다. 특히 아토피피부염의 급성병기에서는 <그림-1>의 B)에서처럼 IL-7-유사 사이토키인(IL-7-like cytokine)이라고 불리는 thymic stromal lymphopoietin(TSLP)이 분비되는데 병소를 유발하는데 중요한 역할을 하는 것으로 추정되고 있다. TSLP는 아토피피부염을 가진 환자의 각질형성세포(keratinocyte)에서 발현이 증가하는 것으로 확인되고 있다. 분비된 TSLP는 골수수지상세포(myeloid dendritic cell) 활성을 촉진하여 Th2세포뿐 아니라 호산구 및 비만세포를 비롯하여 면역세포의 분화를 촉진하여 염증반응에 의한 습진성 병소를 유발한다. 두 번째 가설에서처럼 일반적으로 아토피피부염은 Th2세포-활성 지배적이고 상대적으로 Th1세포 활성의 감소를 통해 Th2세포/Th1세포의 비가 증가하는 특성이 있다. 이러한 비의 증가가 아토피피부염의 발병기에서 급성병기로 진행되는데 중요한 역할을 하며 또한 급성병기의 가장 중요한 면역-세포학적 특성이다.
아토피피부염의 만성병기에서는 긁어 피부가 두꺼워지면서 주름이 심하게 보이는 태선화(lichenification) 병변의 특징이 있다. 이러한 태선화의 주요 원인은 가려움에 기인하는데 가려움의 시작은 아토피피부염이 급성병기에서 만성병기로 전환되는 신호로 이해되고 있다. 급성에서 만성으로의 병기 변화는 Th2세포의 활성에서 Th1세포의 활성으로의 전환에 기인하는 것으로 추정되고 있다. 실제로 가려움을 유도한 마우스에서 Th2세포에서 분비되는 사이이토카인인 IL-4, IL-5, IL-13의 cytokine과 Th2세포 활성에 의해 증가되는 IgG1 항체가 감소되는 반면에 Th1세포에서 분비되는 IFN-γ와 Th1세포에 의해 유도되는 IgG2a와 IgG2b 항체가 증가된다. 또한 다른 병원균에 의한 제2차감염에 의해서도 만성병기의 특성이 유도된다. 따라서 아토피피부염에서 가려움의 시작과 제2차감염은 Th2세포의 활성이 지배적인 급성병기에서 Th1세포의 활성이 지배적인 만성병기로 전환되는 스위치 역할을 한다. 이러한 스위치 역할을 하는 주요 세포는 <그림-1>의 C)에서처럼 IL-12와 IL-18 사이토카인을 분비하는 IDEC(inflammatory dendritic epidermal cells, 염증성 수지상표피세포)와 IL-18을 분비하는 각질형성세포로 추정되고 있다. IL-12와 IL-18 사이토카인은 Th1세포의 활성을 유도한다. 이와 같이 cytokine의 국소적 발현양상은 조직의 면역반응을 조율하는데 중요한 역할을 하는데 아토피피부염에서 cytokine의 발현양상은 발생의 급성병기와 만성병기와 같이 피부병변의 기간에 의해 결정된다. 일반적으로 사람의 아토피피부염에서 급성병기는 발생 3일 이내의 습진성 또는 홍반성 아토피피부염의 조직이 나타나는 시기이며 만성병기는 발생 2주 이상의 시기를 의미한다. 특히 급성병기에서 Th2세포의 지배적인 환경과 더불어 cytokine IL-4, IL-5, IL-13이 증가하고 만성병기에서는 Th1세포의 지배적인 환경과 더불어 cytokine TNF-β, IFN-γ, IL-2이 증가하는 특성이 있다. 이와 같이 아토피피부염의 병기에 따라 병기에 따라 cytokine의 종류가 다른 것을 아토피피부염의 피부병변에서의 cytokine 발현의 2가지상 형태(biphasic pattern)이라고 한다.
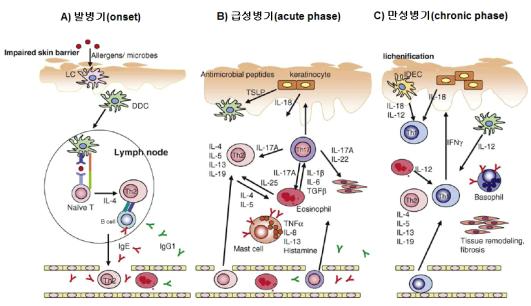
<그림-1> 아토피피부염의 발병기, 급성병기와 만성병기의 특성: 아토피피부염 발생 및 진행에 따른 병변의 특징에 따라 발병기(onset), 급성병기(acute phase) 그리고 만성병기(chronic phase)로 구분되어 설명된다. 발병기에서는 손상된 피부장벽(impaired skin barrier), 급성병기에서는 각질형성세포(keratinocyte)에서 분비되는 (TSLP)thymic stromal lymphopoietin에 의한 습진성 병소, 그리고 만성병기에서는 Th2세포 활성이 IDEC(inflammatory dendritic epidermal cells)에 의해 Th1활성으로 전환되며 태선화(lichenification)의 특징이 있다. eosinophil: 호산구, basophil:호염기구, tissue remodeling, fibrosis: 조직 재형성, 섬유아세포, mast cell: 비만세포, naive T: 미분화 T-세포 (참고: Kawakami).
② 비만세포:
아토피피부염의 급성병기는 Th2세포-지배적인 환경으로 설명되는데 이러한 환경을 유도하는 가장 중요한 요인은 비만세포(mast cell)에서 분비되는 IL-4와 IL-13에 의한 Th2세포 활성에 기인한다. 또한 비만세포는 이들 사이토카인의 분비를 통해 아토피피부염의 가장 중요한 특징인 IgE를 B-세포로부터 합성을 유도한다. 아토피피부염의 증상 측면에서 비만세포는 전반적인 과정에서 발생하는 가려움과 염증 유발에 있어서 중요한 역할을 한다. 비만세포는 골수의 조혈모세포 (Hematopoietic Stem Cell 혹은 Hematopoietic Progenitor Cell)로부터 유래하는 조혈세포이다. 비만세포의 조혈모세포는 순환계에 진입하여 최종 목적지의 조직에 도착하여 성숙된다. 일반적으로 비만세포는 세균 및 기생충에 대한 면역방어뿐 아니라 알레르기 질환이나 IgE-매개 고민감반응을 유도하는데 중요한 역할을 한다. 최근에는 비만세포가 뱀이나 벌의 독소에 대한 자연면역반응뿐 아니라 획득면역에도 관여하는 것으로 확인되고 있다. 그러나 아토피피부염에서 활성화된 비만세포는 <그림-2>에서처럼 3 종류의 다양한 물질을 분비하여 Th2세포의 활성, 피부염증반응과 소양증을 유발한다. 첫 번째 종류로는 단일물질 또는 단백질성 매개체(mediators)인 histamine, serotonin, heparin, chondroitin sulfates, proteases, major basic protein, acid hydrolases, cathepsin이 있다. 두 번째 종류로는 지질성 매개체인 prostaglandins, leukotrienes와 platelet-activating factor (PAF)이 있다. 세 번째 종류로는 성장인자를 비롯하여 사이토카인 및 케모킨인 TNF-α, TGF-β, MIP-1α, MCP-1, VEGF, IFN-α/β/γ, GM-CSF, IL-1α/β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-18와 IL-25 등이 있다.
비만세포에서 분비되는 이러한 매개체 및 사이토카인은 면역반응을 변화시키는 신호전달물질로 작용한다. 비만세포로부터의 이들 물질 분비는 비만세포의 표면에 존재하는 IgE-고친화적 수용체 발현에 기인한다. 항원에 노출되어 IgE-고친화 수용체에 IgE가 결합하게 되면 수용체가 합치거나 서로 연결되어 비만세포의 활성이 이루어진다.
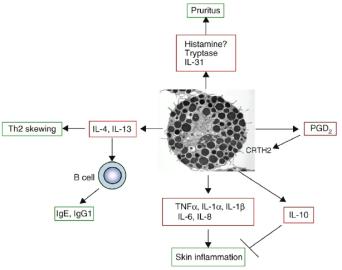
<그림-2> 아토피피부염에 있어서 비만세포의 역할: 아토피피부염에서 활성화된 비만세포는 다양한 매개체 및 사이토카인을 분비하여 Th2세포-지배적인 활성(Th2 skewing), 피부염증반응(skin inflammation)과 소양증(pruritus)을 유발한다. CRTH2: (chemoattractant receptor homologous molecule expressed on Th2, cells), PGD2:prostaglandin D2 (참고문헌: Kawakami).
<참고문헌>
Kawakami Toshiaki, Tomoaki Ando, Miho Kimura, Bridget S Wilson and Yuko Kawakami, Mast cells in atopic dermatitis, Current Opinion in Immunology, 2009;21:666-678.