1. 노화독성학의 방향성
○ 오늘날 노화이론(aging theory)은 다양하게 제시되어 왔다. 본 칼럼에서 노화기전에 대한 기본적인 접근은 “세포노화가 개체노화의 기전”이라는 것을 입증하는 것이다. 이러한 기전을 이해를 통해 암을 비롯하여 퇴행성질환과 어떤 연관이 있는지를 확인한다. 결과적으로 예방과 치료제를 개발하고 또는 개발에 도움을 주는 것 이다.
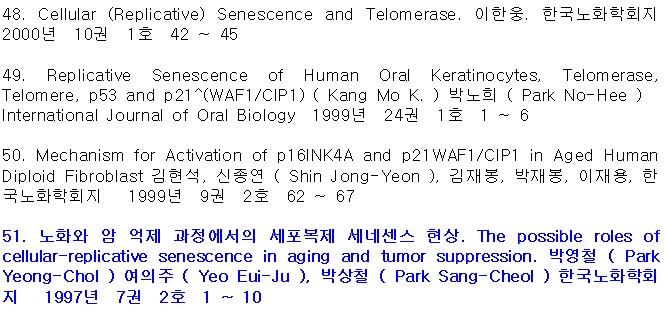
2. 주요 생물학적 및 세포학적 노화이론
○ 다양하게 제시되고 있지만, 노화이론은 단순히 사회학적인 요인이 아닌 생물학적 및 세포학적 노화 측면에서 본다면 <표-1>과 같이 6가지로 귀결된다. 모든 이들 이론은 결과적으로 세포노화를 유도하여 개체노화를 유도한다는 것을 세포복제 세네센스로 증명되어야 한다. 그러나 이들 요인은 후천적 요인이기 때문에 선천적 유전자 결함에 의한 요인은 배제되어 있다고 사료된다. 따라서 세포노화과 개체노화의 증명을 위해 본 칼럼에서는 노화기전과 퇴행성질환에 대한 선천적 요인과 후천적 요인 모두를 기반으로 세포복제 세네센스(Repliactive senescence)로 설명될 것이다.
<표-1> 노화의 생물학적 및 세포학적 이론
3. Replicative Senescence 와 Hayflick limit
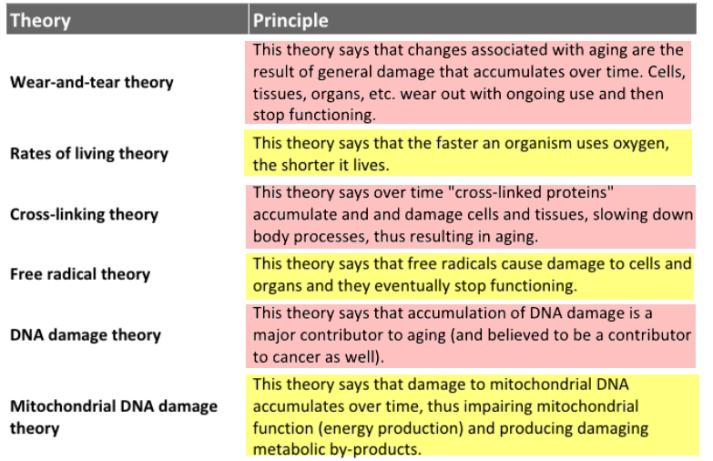
○ Leonard Hayflick은 1965년 그의 논문 “THE LIMITED IN VITRO LIFETIME OF HUMAN DIPLOID CELL STRAINS L. HAYFLICK. Experimental Cell Research 37, 614-636 (1965)“을 통해 태아 폐 섬유아세포(fetal lung fibroblast)인 WI-44를 분리 배양하여 배가증가(population doubling, PD)를 <그림-1>에서처럼 확인하였다. PD는 세포집단의 수가 배가 상황 즉, serial passage(연속적인 계대배양, subcultivation)을 통해 세포집단의 배가 증가의 수적 확인이다. <그림-1>에서 Phase II는 세포증식의 활성화(active cell proliferation) 기간이며 Phase III는 증식의 최종 종식화(eventual failure) 기간이다. 배양 후 약 150일 동안 Phase II를 유지하다가 증식되는 세포수의 감소로 PD가 감소된다. 이러한 감소는 63 PD 즉, 63번의 배가 증식 후 더 이상 증식이 되지 않는 상태에 도달을 유도하는 것으로 확인하였다. 그러나 이들 세포는 세포분열이 멈추어도 외형적으로 생물학적 기능 상실이 없이(no apparent loss of biological function) 생존한다는 것이다. Hayflick은 세포의 불멸화(immortalization)도 생각하였지만, 최종적으로 다음과 같이 결론을 내렸다. ”C onsequently, we advanced the hypothesis that the finite lifetime of diploid cell strains in vitro may be an expression of aging or senescence at the cellular level. Experiments to be described extend the studies of this phenomenon and have further bearing on an interpretation based on a theory of senescence - 정상세포는 무한히 복제할 수 있는 것이 아니라 유한적인 생명주기(finite lifetime)를 가지고 있다는 것이 확인되었다. 이는 in vitro 즉, 세포수준에서 노화(aging 또는 senescence)의 증거 이다”라고 세포수준에서 노화의 최종 마크를 확인하게 되었다. 후에 이를 ‘Hayflick limit(헤이프릭 한계’ 또는 ‘Replicative senescence’라고 불리게 되었다. 따라서 Replicative senescence는 Hayfick limit이며 생물체에서 분리된 세포를 계대배양을 통해 일정한 PD 후 더 이상 분열이 되지 않는 현상이다. 그 당시에는 세네센스 세포의 특성이 잘 파악되지 않았기 때문에 죽지 않고 또한 세포학적 기능이 변화가 없이 비가역적 세포분열 중지(irreversible cell arrest)로 노화의 최종점으로 추정 되었다. 그러나 이후 세포의 세네센스 기전과 여러 지표의 변화가 다양하게 확인되어 질환 및 생물학적 중요성이 더욱 확인되었다.
<그림-1> 인체세포에서 Hayflick limit를 최초로 확인한 in vitro 세포시험
4. Hayflick 교수님에 대하여 (참고: Wikipedia)
○ Leonard Hayflick is 92 years old and was born on 05/20/1928. Leonard Hayflick currently lives in The Sea Ranch, CA. Leonard Hayflick is a Professor of Anatomy at the UCSF School of Medicine, and was Professor of Medical Microbiology at Stanford University School of Medicine. He is a past president of the Gerontological Society of America and was a founding member of the council of the National Institute on Aging (NIA). The recipient of a number of research prizes and awards, including the 1991 Sandoz Prize for Gerontological Research, he has studied the aging process for more than fifty years. He is known for discovering that normal human cells divide for a limited number of times in vitro[1] (refuting the contention by Alexis Carrel that normal body cells are immortal). This is known as the Hayflick limit. His discoveries overturned a 60-year old dogma that all cultured cells are immortal. Hayflick demonstrated that normal cells have a memory and can remember at what doubling level they have reached. He demonstrated that his normal human cell strains were free from contaminating viruses. His cell strain WI-38 soon replaced primary monkey kidney cells and became the substrate for the production of most of the world's human virus vaccines. Hayflick discovered that the etiological agent of primary atypical pneumonia (also called "walking pneumonia") was not a virus as previously believed. He was the first to cultivate the causative organism called a mycoplasma, the smallest free-living organism, which Hayflick isolated on a unique culture medium that bears his name. He named the organism Mycoplasma pneumoniae.
In 1959, Hayflick developed the first inverted microscope for use in cell culture research. To this day, all inverted microscopes used in cell culture laboratories worldwide are descended from this prototype. His microscope was accessioned by the Smithsonian Institution in 2009.
Hayflick developed the first practical method for producing powdered cell culture media in 1965. This method is now used worldwide for the production of many tons of powdered media annually for use in research laboratories and commercial production facilities. The technique is not patented and Hayflick receives no remuneration from this invention.
Hayflick is the author of the book, How and Why We Age, published in August 1994 by Ballantine Books, NYC and available since 1996 as a paperback. This book has been translated into nine languages and is published in Brazil, the Czech Republic, Germany, Hungary, Israel, Japan, Poland, Russia, and Spain. It was a selection of the Book of the Month Club and has sold over 50,000 copies worldwide.
Hayflick and his associates have vehemently condemned "anti-aging medicine" and criticized organizations such as the American Academy of Anti-Aging Medicine. Hayflick has written numerous articles criticizing both the feasibility and desirability of human life extension, which have provoked responses critical of his views

4. Replicative senescence와 Primary cell culture
○ 일반적으로 세포를 이용한 in vitro 실험은 두 종류의 세포주로 이용된다. 우선적으로 생명체에서 분리하여 즉시 세포를 배양하는 일차세포배양(primary cell culture)이라고 한다. 그러나 일차세포배양인 경우 조직에서 막 분리된 대부분의 세포가 새로운 환경에 적응하기가 어려워 일주일 정도 살다가 죽어 버리는 경우가 많다. 이러한 조건은 장시간의 노출이 필요한 실험에는 수행이 어려운 방법이다. 따라서 세포의 지속적 계대배양이 가능한데 이를 수립세포배양(established cell culture)이라고 한다. 나중에 다시 자세히 설명하지만 수립세포배양을 위한 세포주(cell line)들은 불멸화(immortalization)된 세포들이다. 이들 세포주를 만드는 방법은 cell cycle(세포주기)의 지속과 연관되어 있다. 따라서 복제 senescence cell은 primary cell culture를 통해 그 현상 확인이 가능하다.
5. 국내의 Replicative senescence에 대한 연구에 대한 흐름
○ 한국의학논문데이터베이스(KMBASE)를 통해 Replicative Senescence와 관련된 국내발표논문은 136편이며 주요 논문은 아래와 같이 51편을 요약하였다. 연구의 흐름은 ① 세포 복제 세네센스에 대한 소개, ② 약물 처리를 통한 replicative senescence 연장과 암화, ③ 줄기세포의 senescence 현상에 의한 노화와 생물학적 변화 등으로 확인되었다. 또한 켐온의 노화독성학 출발점에 대한 당위성도 확인되었다. 앞서 소개된 1997년 발표된 논문인 노 화와 암 억제 과정에서의 세포복제 세네센스 현상(The possible roles of cellular-replicative senescence in aging and tumor suppression)이 아래의 <참고자료-1>에서처럼 1997년 ㈜켐온이 노화이론의 핵심인 replicative senescence 현상과 telomere의 관계를 국내 처음으로 저널에 소개한 것으로 확인되었다. 저자의 소속 이전 경력으로 이렇게 주장하기에는 다소 쑥스러움 점은 있다. 그러나 향후 몇 개월에서 1년 정도의 칼럼을 통해 보다 정밀한 이론을 공유하면서 ㈜켐온은 퇴행성질환의 실험 모델, 예방과 치료제 개발에 중요한 초석을 놓을 것이다. 더욱 중요한 것은 세포생물학적 기본 원리에서 벗어나지 않고 건강화 노화를 위한 접근이라는 점이다.
<참고자료-1>