1. 생명체의 단위- 세포의 수와 교체
○ 모든 생물체는 4가지 거대분자인 핵산(또는 DNA), 단백질, 지질과 당과 더불어 미네랄로 구성되며 기본단위는 세포(cell)이다. 성인은 크기에 따라 세포 수가 차이가 있지만, 평균적으로 약 60 조개로 구성되어 있다. <그림-1>은 인체의 조직 또는 기관별 세포 수를 나타낸 것이다.
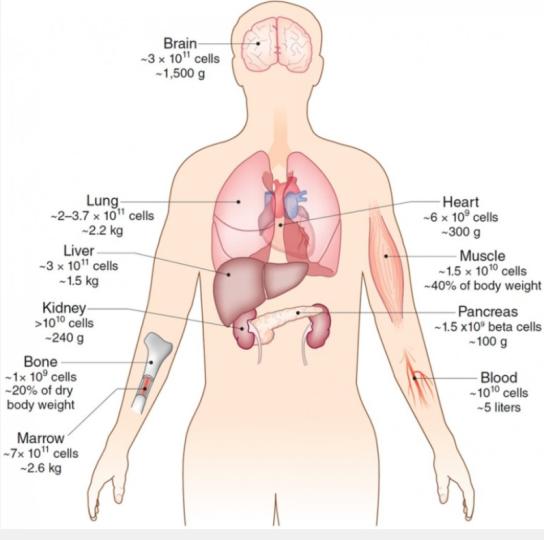
<그림-1> 인체의 조직 또는 기관별 세포 수
○ 그러나 세포의 수는 인체 무게와 비례하지는 않는다. <그림-2>에서처럼 인체에서 적혈구가 인체 구성 세포의 비율로 가장 높은 84%이지만 질량으로는 2.5kg에 불과하다. 반면에 근육세포와 지방세포는 수적으로 전체의 0.1%에 불과하지만, 인체 무게의 75%를 차지한다.
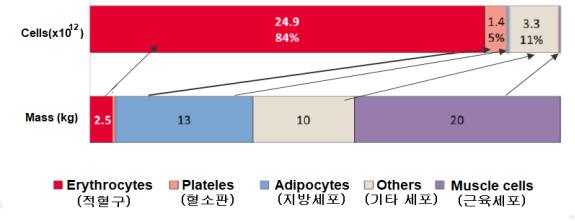
<그림-2> 인체의 세포별 개수 및 무게(Sender et al, 2016)
○ 이들 세포는 사멸(apoptosis)과 재생(replication)을 반복하는데 1초에 약 50 만개의 세포가 사멸하며 동시에 50 만개의 세포가 복제되어 재생된다. 어떻게 보면 성인에서 재생이 되지 않는 신경세포 등의 일부 세포 종류를 제외하고 모든 세포들이 교체된다고 할 수 있다. 이는 육체적으로 우리는 매일 다른 사람이 된다는 것을 의미한다. 만약 중추신경계나 말초신경계를 구성하는 신경세포도 일정한 비율로 매일 교체가 된다면 신경연접(synapse) 측면에서 많은 차이를 유발하게 된다. 결과적으로 인식의 차이와 외부적 행동의 변화로 인간의 개별 정체성에서 문제를 유도할 것으로 사료된다.
2. Replicative senescence의 특성
1) Replicative senescence vs cellular senescence vs Premature senescence
○ 일반적으로 세포의 정상적인 분열 과 더불어 자연적으로 유도되는 복제 세네센스(replicative senescence)를 cellular senescence(세포 세네센스)이라고 하며 분열 외에도 세포의 내외적 요인에 의해 세포 자체가 가지고 있는 PD(population doubling, 배가증식)의 잠재력보다 빨리 유도되는 복제 세네센스 현상을 ‘Premature senescence(조기-세네센스) 또는 stress-induced premature senescence(SIPS, 스트레스 유도성 조기 세네센스)’ 이라고 한다. 대부분의 세포 PD가 약 50번 정도이며 이후 cellular senescence에 돌입하지만, 유해활성산소 또는 독성물질 등의 외부적인 요인을 비롯하여 유전적 질환에 의해 premature senescence에 도달하게 된다. 그러나 요인이 무엇인가에 상관없이 어떤 세네센스 세포라도 세포주기 및 세포분열의 비가역적 중지라는 개념은 동일하다.
2) Replicative senescence의 3가지 특성
○ 복제세네센스 현상에 있어서 분열정지는 일시적으로 분열 중단된 세포(quiescent cell), 최종 분화(terminal differentiations)에 의한 분열 정지된 세포 등과 세포학적 측면에서 유사점도 많으나 다음과 같은 세 가지 다른 특성에서 차이점이 있다.
① 유사분열 촉진제(mitogen)에 대한 세포주기의 무반응: 세네센스 세포는 유사분열 촉진제(mitogen)에 의한 세포주기에 반응이 없으며 G 1 의 DNA 상태로 분열 정지된다. 또한 DNA 합성 후 시기인 G 2 시기에서도 비가역적으로 발생하는 것으로 확인되고 있다. 예를 들어 세포주기의 신호전달체계와 관련이 있는 EGF(epidermal growth factor), IGF(insulin-like growth factor) 그리고 PDGF(platelet-derived growth factor) 등 분열 및 성장촉진인자에 대한 반응이 복제세네센스 세포에서 현저히 저하된다. 특히, <그림-3>에서처럼 G 1 시기의 조절과 관련하는 전사인자(transcription factor)인 AP1이나 E2F의 활성이 억제되며 동시에 cyclin-dependent kinase(cdk) 저해제인 p21이나 p16의 활성이 증가된다. 이와 같은 기전의 결과로 복제 세네센스 세포의 가장 중요한 특성인 비가역적 세포주기의 영구 중지(irreversible-permanent arrest of cell cycle)를 유도한다. 일반적으로 암세포의 특성이 무한적인 세포주기의 진행이라는 점을 고려할 때 세네센스 세포의 이와 같은 비가역적 세포주기의 영구 중지는 어쩌면 암세포로의 전환에 대한 최후의 방어기전 으로 이해된다. 정상적인 세포의 노화가 진행되면서 많은 기능이 상실된다. 이는 암화에 대한 세포 자체의 저항성이 감소될 수 밖에 없다. 따라서 세포주기의 중지라는 극단적인 특성이 북제 세네센스 현상은 암세포로의 전환에 마지막 기전이 되는 것으로 이해된다. 결론적으로 복제세네센스 세포는 일반 세포의 세포주기와 관련된 신호전달체계에 있어서 상당한 차이가 존재한다.
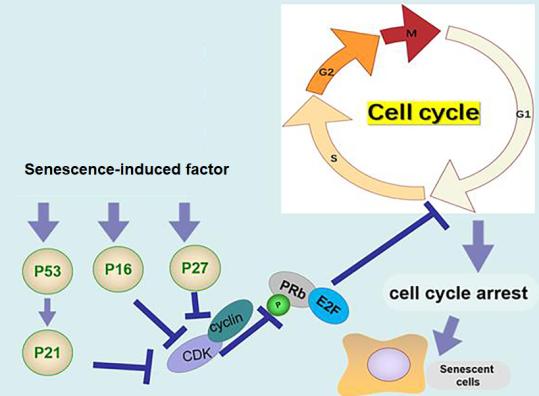
<그림-3> 세포주기(cell cycle)-신호전달체계의 변화로 cell cycle arrest 및 senescent cells
<참고문헌: Chi Yan, Zhimeng Xu, Weiqiang Huang. Cellular Senescence Affects Cardiac Regeneration and Repair in Ischemic Heart Disease[J]. Aging and disease,10.14336/AD.2020.08.11.)
② 단백질 발현에 있어서 차이(Altered gene expression): 대사 및 기능적인 측면에서 세네센스 세포는 단백질 발현에 있어서 차이가 있다. 세포외 간질(extracellular matrix)을 구성하는 콜라겐분해효소(collagenase), 스트로메리신(Stromelysin) 그리고 피브로넥틴(fibronectin) 등의 활성이 정상세포와 비교하여 복제세네센스 세포에서 상당히 증가된다. 대사적 측면에서 다른 세포들과 비교하여 다소 낮은 대사율을 보이지만 복제세네센스 세포는 여전히 활성적이며 장기간에 걸쳐 수명이 지속된다. 특히 가수분해효소를 함유하고 있는 리소좀(lysosome) 활성의 변형으로 발생하는 β-galactosidase 발현이 복제세네센스 세포에서 높은 것으로 확인되었다. 이는 일시적으로 분열 중지된 세포 또는 최종 분화에 의해 분열 정지된 세포 등과 구별하는 생물학적 지표 효소이다.
③ A poptosis에 대해 높은 저항성: Apoptosis란 세포가 스스로 죽는 세포자멸사를 의미한다. 아포토시스는 신체에 그 세포가 더 필요 없거나 그 세포가 유기체의 건강을 위협하는 등 여러 가지 경우에 발생한다. 복제세네센스 세포는 apoptosis에 대해 높은 저항성을 갖는다. 이는 복제세네센스 현상이 비가역적으로 분열 정지되지만 죽음으로 즉시 유도되지 않는다는 것을 의미한다. 아포토시스에 대한 높은 저항성에 대한 기전은 anti-apoptosis 유전자인 Bcl-2의 발현이 증가하는 것으로 일부 설명되고 있다.
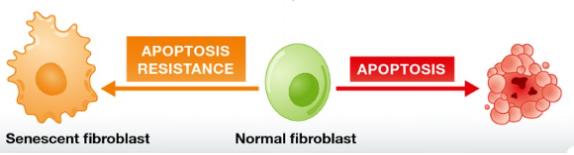
<그림-4> 세포의 apoptosis와 senescence에 있어 다른 신호전달체계
○ 이상과 같이 세네센스 상태의 세포는 일시 중지된 젊은 세포를 비롯하여 최종 분화에 의한 세포 중지된 세포들과 달리 여러 측면에서 명확한 차이를 보인다. 이는 세포주기에서 DNA 합성 및 세포 복제와 관련된 여러 조절 단백질의 발현 조절과 밀접한 관계가 있으며 복제세네센스 현상의 세포학적 그리고 생물학적 의의를 규명하는데 중요한 특성이다. 그러나 오늘날에는 질환과 관련하여 세네센스 세포의 특성이 다음과 같이 5가지 특성으로 제시되고 있다.
3. Replicative or cellular senescence의 주요 변화와 연관된 질병
1) 세포 세네센스에 의한 노화, 그리고 노화-관련 질환을 유도하는 5대 변화
○ 복제세네센스 현상의 생물학적 중요성은 세포복제 횟수의 유한성이라는 특성에서 알 수 있듯이 노화와 암을 비롯한 노화-관련 질환의 원인 및 관련성 에 집중되어 많은 연구가 새롭게 이루어졌다. <그림-4>는 세포 노화 촉진 및 노화-관련 질환의 원인으로 고려되는 세포 세네센스에 의한 기능적 변화 및 영향을 나타낸 것이다. 기능적 변화는 1) 지속적인 염증 촉진(promoting persistent inflammation), 2) 재생능력의 상실(impaired regenerative capacity), 3) 정상적인 세포 기능의 상실(loss of normal cell function), 4) 단백질 분해효소에 의한 세포외기질(Extracellular Matrix, ECM) 성분의 감소 또는 변성, 5) 주변 세포의 이상 반응의 유도(altering behaviour of neighbouring cells) 등의 5가지로 요약된다.
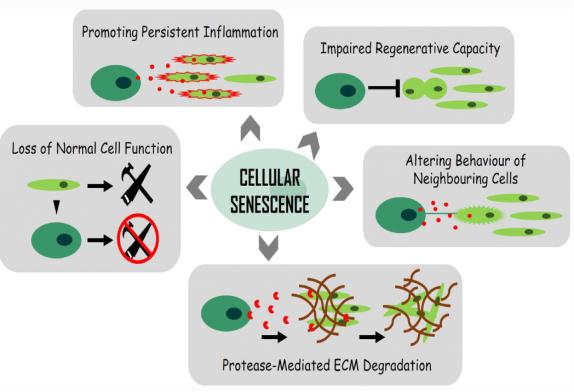
<그림-5> 세포 세네센스에 의한 노화와 노화관련 질환
<참고문헌: Dominick G. A. Burton . Richard G. A. Faragher. Obesity and type-2 diabetes as inducers of premature cellular senescence and ageing. Biogerontology (2018) 19:447
2) Altering behaviour of neighboring cells의 예시
○ 정상세포와는 다르게 세네센스 세포는 여러 가지 기능적 변화가 유발되는 것은 당연하다. <그림-5>에서처럼 변화 중 가장 새로운 현상은 주변 세포의 이상 반응의 유도(altering behavior of neighboring cells) 이다. 이는 세네센스 자체에 대한 변화뿐만 아니라 다른 세포에 대한 영향이라는 측면에서 개체 노화의 중요한 기전으로 이해될 수 있다 . <그림-6>에서처럼 세네센스 세포(senescent cell)는 특정 물질의 생산 및 분비를 통해 세네센스 세포 그 자체에 영향을 주는 자가분비형 신호전달(autocrine signaling), 그리고 주변 다른 정상적인 세포에 영향을 주는 측분비 신호전달(paracrine signaling) 기능을 한다. 세네센스 세포가 분비하는 물질을 SASP(senescence-associated secretory phenotype, 세네센스-연관 분비체 ) 또는 SMS(Senescence Messaging Secretome, 세네센스-송달 분비체)이라고 한다. 이들 SASP는 사이토카인, 케모킨, 성장인자 그리고 단백질분해효소 등의 혼합물로 구성되어 있으며 잠재적 염증(pro-inflammation) 유발 요인이 된다. 특히 SASP/SMS에 의한 paracrine signaling은 세네센스 세포가 주변의 다른 젊은 세포나 원거리 세포를 자극하여 세네센스 세포로의 전환을 유도하게 되는 것으로 알려졌다. 그 동안 무척이나 궁금했던 세포 수준의 노화가 개체 수준의 노화로 어떻게 발생하는지를 설명해 주는 기전이라고 할 수 있다. 공부로부터 헤어날 수 없는 즐거움이다.
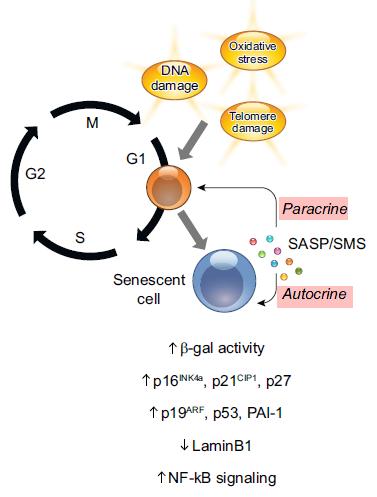
<그림-5> 세네센스 세포의 autocrine signaling과 paracrine signaling
(참고문헌: Arianna Calcinotto, Jaskaren Kohli, Elena Zagato, Laura Pellegrini, Marco Demaria, and Andrea Alimonti. CELLULAR SENESCENCE: AGING, CANCER, AND INJURY. Physiol Rev 99: 1047
예시 1) 세포 세네센스에 의한 뇌노화와 질병 유발 기전: 세네센스 세포가 SASP(세 senescence-associated secretory phenotype, 세네센스-연관 분비체 )을 획득하여 주변 세포 및 조직에 영향을 줄 수 확인되었다. 이들 SASP는 사이토카인 케모킨, 성장인 그리고 단백질분해효소 등의 혼합물로 구성되어 있으며 잠재적 염증(pro-inflammation) 유발 요인이 된다. 예를 들어 말초 조직에서 세네센스 세포가 발생하고 이들에 의해 분비되는 SASP가 중추신경계로 이동 및 뇌신경세포의 세네센스를 유도하여 인지기능을 감소시키는 뇌질환을 유도할 수 있다는 가설이 제시되었다. 따라서 <그림-6>과 같이 알츠하이머병(Alzheimer’s disease)과 파키슨병(Pakinson’s disease) 등 퇴행성 뇌질환의 치료에 있어서 세네센스 세포가 표적이 될 수도 있다.
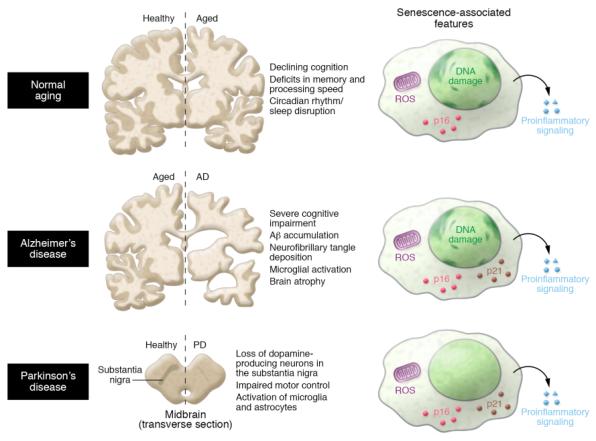
<그림-6> 정상적인 노화(normal aging)와 중추신경계 질환의 뇌에서 Senescence
(참고문헌: Baker, D. J., & Petersen, R. C. (2018). Cellular senescence in brain aging and neurodegenerative diseases: Evidence and perspectives. Journal of Clinical Investigation, 128(4), 1208-1216)
예시 2) 프레그런스저널코리아 FJK 2019년 4월호 [특집] 화장품 신소재와 원료의 새로운 연구 결과 (최현정 기자 hikari_0706@cosinkorea.com. 등록 2019.04.18. 15:48:00)
○ 기사 - 홍조류 추출물에 의한 SMS 제어와 안티에이징: 일본을 비롯한 많은 선진국이 고령화 사회에 돌입하면서 연령증가(aging)에 따른 심신의 변화, 즉 노화 (senescence)에 대한 생각이 변화해 왔다. 노화에 적응할 것을 염두에 두고 그 연령에 맞게 최고의 건강 상태를 유지하는 ‘헬시 에이징(healthy aging : 건강한 노화)’이라는 개념이 확산되고 있으며 스킨케어에 대한 접근방식에도 변화가 요구되고 있다.
인체 세포가 분열할 수 있는 횟수는 정해져 있다고 생각되고 있으며 분열의 한계를 맞은 세포는 노화세포(senescent cell)라고 불린다. 최근에는 SMS(Senescence Messaging Secretome) 라고 불린다. 노화세포에서 대량의 염증성 사이토카인이 분비되는 현상이 확인되어 연구가 진행되고 있다. SMS는 주변의 젊은 세포에 영향을 줘 노화의 징후를 가속한다고 여겨지고 있다. 홍조류(아스파라곱시 스아르마타) 추출물은 SMS로 인해 유도된 노화에서 젊은 세포를 보호하고 전염성 노화를 감소시킨다. 또 해당 추출물 배합제품에 의한 임상시험을 실시한 결과, 피험자의 헬시 에이징에 기여하는 결과를 얻을 수 있었다. 본고에서는 홍조류 추출물의 SMS 제어를 통한 전염성 노화의 조절작용과 헬시 에이징과 피부 외관으로의 영향에 관한 검토결과를 소개한다. 아스파라곱시스아르마타(Asparagopsis armata)는 가시를 가진 작은 홍조류이며 선체에 걸린 것이 원산국인 호주에서 유럽에 다다르게 된 것으로 알려져 있다. 아스파라곱시스아르마타는 생태계에서 해양 동물인 군소(sea hare)의 먹이가 되고 있다. 군소는 위험을 경계하기 위해 서로 화학통신을 하는 습성을 가지며 이 통신에는 아스파라곱시스아르마타에서 유래하는 MAA(Mycosporine-like Amino Acids)가 이용되고 있다.