1. 세포 복제 세네센스 현상과 개체노화의 관계에 대한 의미
○ 앞서 복제 세네센스 현상이 세포노화와 밀접한 관계가 있다는 것을 다음과 같이 5 가지 측면에서 설명이 되었다.
① 연령과 수명이 다른 종의 Population Doubling (PD: 배가증식) 차이
② 종이 다른 동물의 PD는 최대수명과 비례적 관계
③ 유전질환인 선천성 조로증 (premature aging syndrome) 환자의 PD 감소
④ 유해활성산소(ROS, reactive oxygen species)에 의한 세네센스 현상 촉진
⑤ Telomere의 세네센스 유도
○ <그림-1>은 세포 수준(cellular level)의 복제 세네센스(senescence) 현상이 개체 수준(organismal level)에서 유사하게 발생하는 가설을 표현한 것이다. 개체가 수많은 세포로 구성되어 있으며 세포는 생명체의 기본 단위이라는 측면에서 이러한 가설은 당연하게 받아들일 수 있다. 그러나 세포의 복제 세네센스 현상이 생명체에서 세포가 분리되어 in vitro(시험관)에서의 배양을 통해 확인된 현상이기 때문에 (세포의 복제 세네센스 현상 = 개체노화) 의 공식을 수용하기가 쉽지 않다. 따라서 복제 세네센스 현상이 개체노화와 원인 또는 밀접한 관계가 있다는 것을 개체수준에서 증명이 필요하다.
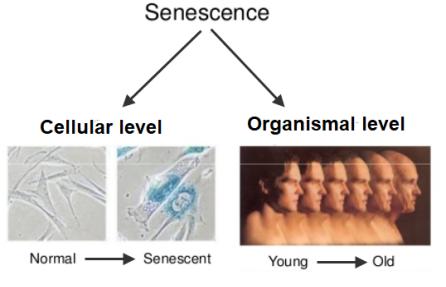
<그림-1> 세포의 복제 세네센스와 개체 수준의 노화와 관계를 나타내는 모식도
2. 세포 세네센스가 개체노화 원인과 기전이라는 주관적 예시
○ 세포의 복제 세네센스에 의한 개체노화, 특히 사람의 노화와의 연관성을 증명하기에는 쉬운 일이 아니며 또한, 장기간의 추적 연구가 필요하다. 어쩌면 이데아와 물자체와 같은 것일 수도 있다. 따라서 아래의 2가지 내용은 복제 세네센스에 대한 이론에 기초하여 개인의 주관적 추정으로 사례를 들은 것이다. 비록 믿거나 말거나일 수도 있지만, 논리적 보편성은 추구하였다.
① 복제양 돌리(clone sheep Dolly)의 예시
② 유해활성산소 생성에 대한 예시
1) 복제양 돌리(clone sheep Dolly)의 예
① 복제양 돌리의 탄생: 1997년 2월, 영국 에든버러 로슬린 연구소의 I. 윌머트 연구팀이 다 자란 암컷 양에게서 채취한 체세포를 이용하여, 복제기술로 세포를 제공한 암컷 양과 똑같은 유전정보를 지닌 새끼 양 돌리(Dolly)를 1996년 7월 5일 탄생시켰다고 발표했다. 생식세포를 사용한 복제기술은 이미 실용화되어 축산 등에 이용되고 있었지만, 새끼 양 돌리의 경우는 다 자란 암컷 양의 체세포를 이용하여 복제했다는 점이 획기적이었다. 생명체의 세포에는 개체의 모든 기관을 만들어내는 유전자가 포함되어 있는데, 성장하여 완전히 분화한 체세포로부터 불러낸 유전정보는 특정 기관을 만드는 정보에 한정되어 있다. 여기서는 채취한 체세포를 배양하는 과정에서 영양 상태를 극도로 악화시켜 세포의 활동이 정지 상태가 된 단계에서 적절한 자극을 가함으로써 세포 속의 모든 유전자를 활성화시킨다. 이것을 또 다른 양의 세포핵이 제거된 난자에 이식·융합시켜서 성장시킨 것이다. 이 기술을 이용해 경제성이 높은 가축을 대량으로 복제할 수 있을 뿐만 아니라 인간에게도 응용할 수 있기 때문에 윤리적인 측면에서 문제를 지적하는 비난의 소리가 높으며, 복제연구소를 규제하려는 움직임이 세계각국에서 일어나고 있다. 돌리는 2003년 심각한 폐질환에 걸려 안락사시켰다. 생후 6년 6개월만이었다.
② 돌리의 죽음과 세네센스와의 관계: 앞의 서술 내용은 ‘다음 백과’에 서술된 내용으로 돌리가 태어난 과정을 <그림-2>의 A)와 같이 요약할 수 있다. 지금부터 세포 복제 세네센스와 복제양 돌리의 사망과의 관계는 생명과학을 전공한 사람으로 세포노화와 개체노화의 연관성에 대한 개인의 추정이다. 복제양은 난자에서 핵을 제거한 무핵난자에 2n 체세포 염색체를 주입하여 탄생한 것이다. 이후 폐질환으로 사망하여 <그림-2>의 B)처럼 박제되어 스코틀랜드 박물관에 전시되어 있다. 여기서 돌리의 사망 원인인 폐질환과 폐세포의 조기 세네센스(premature senescence)과 연관하여 인과관계를 추정하였다. 생식세포 특히, 정모세포는 수많은 분열 후 정자를 생성하게 된다. 정모세포 및 정자는 세포의 세네센스 현상이 적용되지 않는다. 즉 정모세포의 수많은 분열을 통해 생성된 정자의 텔로미어는 짧아지지 않는다. 즉, 최종적으로 수십 및 수백 번 분열된 정자가 난자에 수정되더라도 그 후 탄생한 생명체는 정상적인 복제 세네센스 및 평균수명을 유지한다. 이는 정모세포 및 정자에 텔로미어를 합성하는 효소가 존재하기 때문이다. 이와 관련된 효소는 텔로미어와 함께 향후 상세히 논할 것이다. 복제양 돌리의 유전적 특성은 난자와 정자가 아니라 일종의 체세포의 특성이다. 즉, 복제양의 2n 염색체는 5살인 어미 양의 유방에서 분리된 체세포이며 이는 출생 후 5년 동안 population doubling이 많이 진행되었다는 것을 의미한다. 일반적으로 양의 평균수명은 12년이다. 복제양 돌리는 태어나서 1996년에 태어나 2003년에 사망하여 약 7년을 생존하였다. 산술적으로 복제양 돌리는 출생과 동시에 5년 동안 분열을 통해 단축된 텔로미어를 가지고 있었다. 체세포 수정란의 출생 때까지의 분열에 의한 텔로미어 단축은 자체의 텔로미어 합성효소의 활성에 의해 어미 양의 체세포에서 텔로미어 단축은 발생하지 않는다. 그러나 출생 후 더 이상의 텔로미어 합성효소의 활성은 소멸된다. 이에 짧아진 텔로미어를 가진 복제양 돌리의 출생은 정상적인 양의 평균수명이 복제 세네센스가 아니라 어미 양과 유사한 PD 횟수 후 복제 세네센스의 돌입하게 된다. 이러한 점을 고려하여 산술적인 측면에서 양의 평균수명 12년에서 체소포 분리 시 어미 양의 나이 5년을 빼면 복제양 돌리의 생존 가능 기간은 7년이면 이와 유사한 기간을 살고 죽었다는 추정이 가능하다.
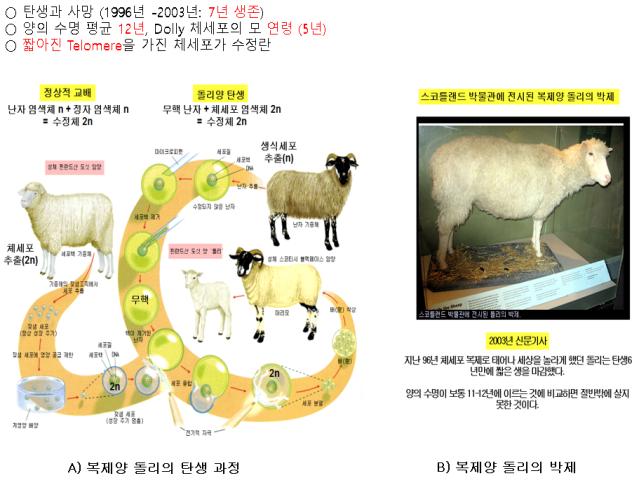
<그림-2> 복제양 돌리의 탄생 과정과 사후 박제된 돌리
③ 복제양 돌리의 조로증과 텔로미어 단축에 의한 폐질환: <그림-3>은 복제양 돌리의 사망과 텔로미어 단축에 의한 사람의 질환 기전을 나타낸 것이다. <그림-3>의 A)에서처럼 복제양 돌리는 조로증(premature aging)과 폐질환으로 사망한 기사 내용이다. 여기서 조로증이란 양의 평균수명에 도달하기 전에 노화가 진행된 것을 의미하며 이러한 조로증은 폐질환을 유도하여 돌리의 사망 원인으로 지적하고 있다. 또한 <그림-3>의 B)는 다양한 요인에 의한 텔로미어 단축으로 폐질환을 포함하여 골수질환과 악성종양 등의 질환이 발생하는 과정을 설명하고 있다(Rodrigo et al., 2008). 이와 같이 종간 차이는 있을 수 있지만, 포유동물에서 복제양의 돌리는 짧아진 텔로미어에 의한 조로증과 이에 의한 폐질환으로 사망한 것으로 추정된다.
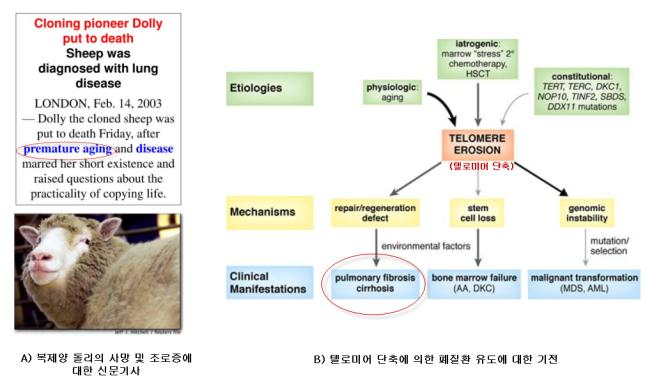
<그림-3> 복제양 돌리의 조로증에 의한 사망과 텔로미어 단축에 의한 폐질환 기전
<참고문헌: Rodrigo T. Calado, Telomere maintenance and human bone marrow failure. Blood (2008) 111 (9): 4446
2) 유해활성산소의 예
① 유해활성산소의 최대 생산의 세포기관 및 효소: <그림-4>의 A)에서처럼 정상적인 신체 활동 하에서 유해활성산소(reactive oxygen species, ROS) 및 산화적 스트레스(oxidative stress)의 대표적인 장소는 에너지 생성의 주요 장소인 미토콘드리아이며 호흡계(respiratory system)이다. 대표적인 ROS는 H 2 O 2
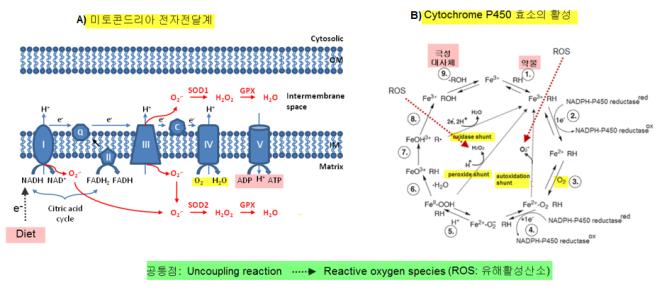
<그림-4> 미토콘드리아 전자전달계와 cytochrome P450 system의 부조화 반응에 의한 ROS 생성 기전
② 미토콘드리아에서 유해활성산소 생성과 종간 평균 수명과의 관계: <그림-5>는 간세포(liver cell)의 미토콘드리아에서 생성되는 유해활성산소의 특정 단백질 용량 당 H 2 O 2 (hydrogen peroxide, 과산화수소) 생성량에 따른 동물종 별 최대수명(maximum life span, MLSP)의 차이를 나타낸 것이다(Sohal et al. 1990). 최대수명이 길수록 미토콘드리아에서 유해활성산소 생성이 비례적으로 감소하는 것을 알 수 있다.
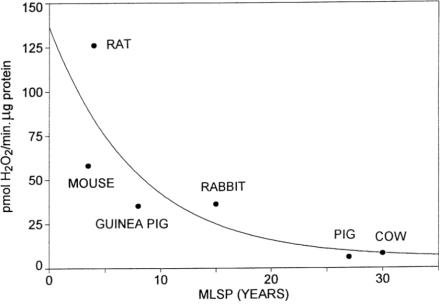
<그림-5> 미토콘드리아에서 유해활성산소(H 2 O 2 ) 생성에 따른 동물 종별 최대수명(maximum lifespan)
③ 식이제한(caloric restriction)과 최대수명과의 관계: 식이의 대사 과정에서 발생한 전자는 NADH 형태로 미토콘드리아의 전달전달계에 전달된다. 전달된 전자는 ATP 합성에 관여하며 산소는 최종 전자 수용체로서 전자와 수소 이온을 받아 물로 환원이 된다. 과식에 의한 과잉 생산된 전자(NADH)는 부조화 반응에 기인하여 전자전달계에서 수소와 함께 반응하여 물이 되는 것이 아니라 산소에만 전자가 전달되어 superoxide anion radical의 ROS가 생성된다. 따라서 과식은 과잉 전자의 생성과 전자전달계로의 유입으로 부조화 반응을 통해 ROS를 발생하게 된다. <표-5>는 흰쥐(white rat), 민물고기인 guppy, 거미인 Doily spider, 물벼룩(water flea), 원생동물(protozoan)과 인간(human)에 평균수명과 최대수명을 식이제한 또는 열량제한에 따른 차이를 나타낸 것이다. 열량제한을 1일 40% 정도를 하였을 경우, 모든 종에서 평균수명 및 최대수명이 대략적으로 30%에서 50% 정도 증가가 되는 것이 확인되었다. 이는 미토콘드리아에서 ROS의 낮은 발생으로 미토콘드리아 손상의 저해. 그리고 세포의 세네센스 지연에 의한 개체노화의 지연을 유도하는 것으로 추정된다.
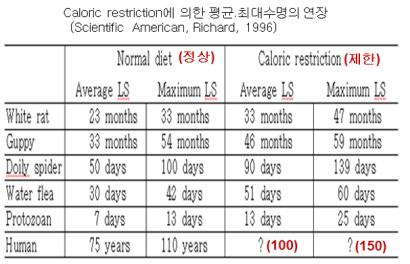
<표-1> 식이제한에 의한 평균수명(average life span)과 최대수명(maximum life span)의 연장
④ 직업에 따른 평균수명과의 관계: <그림-6>은 김종인 등(2011, 동국대학교)에 의해 수행된 연구 결과로 1963-2010년까지 48년 동안 언론에서 확인된 3215건의 부음기사와 통계청 사망통계를 분석한 직업별 평균수명을 나타낸 것이다. 체육인이 가장 낮은 평균수명이 확인되었다(연합뉴스, 2011.04.01.). 이는 순발력과 지구력이 요구되는 스포츠에서 과도하고 순간적인 에너지의 사용으로 ATP 합성 공장인 미토콘드리아에서의 과도한 ROS 생성에 의한 세포 세네센스와 개체노화에 기인하는 것으로 추정된다.
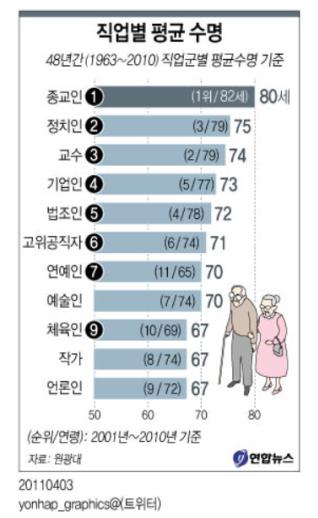
<그림-6> 언론 부고를 통해 확인된 직업별 평균수명
⑤ 35년 동안 혼수상태에서 깬 엄마와 자식들의 외모 비교: <그림-7>은 서울스포츠 1996년 4월 12일 실린 기사의 내용이다. 아들과 딸이 15세 및 8세 때, 그리고 32세 엄마가 교통사고를 당하여 혼수상태에 빠졌다. 그 후 35년이라는 세월이 흘러 67세가 된 엄마가 혼수상태에서 기적적으로 깨어났다. 엄마의 모습이 50세 아들과 43세 딸보다 더 젊게 보인다. 혼수상태에서는 최저 기초대사로 유지되었을 것으로 추정된다. 최저 수준의 기초대사는 미토콘드리아에서 ROS 생성이 거의 발생하지 않았을 것이다. 이는 최저 수준의 ATP 및 ROS 생성으로 생명이 35년 동안 유지되었을 것으로 이해된다. 결과적으로 최저 ROS 생성이 최저 수준으로 세포분열이 유지되어 텔로미어 단축의 예방과 이에 의한 지연된 복제 세네센스가 개체노화 지연의 원인으로 추정된다.

<그림-7> 교통사고에 의해 35년 동안 혼수상태에서 깬 엄마(아래)와 두 자식의 외모 비교