<핵심 주제> 세포 replicative senescence의 집중 탐구에 대한 방향
① 텔로미어에 의한 복제 세네센스의 유도 기전
② 세포의 복제 세네센스와 개체노화의 기전
③ 텔로머라제(telomerase, 텔로미어 합성효소)에 의한 수명 연장과 암과의 관계
④ 조기 세네센스(premature senescence)와 퇴행성 질환과의 관계
⑤ 생활 및 산업·환경 독성물질 노출에 의한 조기 세네센스
1. 텔로미어-의존성 세네센스((telomere-dependent senescence)
○ Hayflick은 1965년에 섬유아세포의 시험관 배양을 통해 세포 복제의 횟수 (replicative life span)가 유한하다는 것을 확인하였다. 즉 세포복제 능력인 배가증식 (PD: population doubling)이 세포의 종류마다 차이가 있지만 결국 일정한 횟수를 분열한 후 상실된다는 것이다. 이러한 제한된 횟수에 도달하면 더 이상 PD를 할 수 없는 상태를 일컬어 “Replicative Senescence(복제세네센스)"이라고 하며 ”irreversible growth arrest(비가역적 세포복제 중지)"라 정의된다. 최근 다양한 세포로 구성된 개체를 통해서도 이러한 현상이 확인되었으며 특히 복제 횟수 정도와 세포노화의 진행 정도가 비례한다는 것뿐 아니라 세포의 암세포로의 전환과도 밀접한 관계가 있다. "Hayflick 한계(limit)"라고도 일컫는 복제세네센스 현상에 있어서 분열정지는 일시적으로 분열 중단된 세포(quiescent cell), 최종 분화(terminal differentiations)에 의한 분열 정지된 세포 등과 세포학적 측면에서 차이가 있다고 설명하였다. 일반적으로 복제 세네센스는 세포분열시 발생하는 텔로미어 단축에 의해 발생하는 텔로미어-의존성 세네센스(telomere-dependent senescence)를 의미한다.
2. 텔로미어 단축의 기전- 3' 말 단복제문제(end replication problem)
① 3' 말단복제문제(end replication problem):
세포분열 시 S phase에서 DNA 복제는 origin이라는 위치에서 양방향으로 복제가 이루어지며 DNA 합성은 한쪽 방향인 5´에서 3´방향으로만 진행된다. 이는 DNA 중합효소가 당의 5'-3'방향으로만 당-인산 결합을 만들 수 있기 때문이다. <그림-1>의 A)서 5'에서 3' 방향으로 합성되는 가닥을 선도가닥(leading strand), 반면에 3에서 5´방향으로 합성되는 가닥을 지연가닥(lagging strand)이라고 한다. DNA 합성은 RNA primer가 parent strand에결합하여 시작되는데 선도가닥에서는 연속적으로 복제가 이루어진다. 반면에 지연가닥에서는 지속적으로 RNA primer가 단편적으로 합성된다. 즉, 지연가닥에서 합성과정에서는 아직 열리지 않은 template DNA의 3'말단에서부터 복제를 시작할 수 없다, 이에 primase를 이용하여 RNA primers를 합성하면서 5`- 3`방향의 짧고 불연속적인 조각인 오카자키 절편(Okazaki fragment)으로 합성된다. 오카자키 절편(Okazaki fragment)은 DNA 복제가 불연속적으로 일어나는 지연가닥(lagging strand)에서 합성되는 상대적으로 짧은 길이의 DNA조각이다. 그 길이는 대장균은 1,000~2,000 뉴클레오타이드이며, 진핵생물에서는 일반적으로 100~200 뉴클레오타이드이다. 선도가닥에서는 RNA primer가 교체되지만 지연가닥에서는 RNA primer의 -OH 3´말단을 DNA polymerase가 합성을 할 수 없다. 따라서 지연가닥은 RNA primer 교체되지 않아 그 만큼 DNA 합성이 되지 않는다. <그림>의 B)에서처럼 세포분열 시 지연가닥에서는 마지막 RNA primer가 DNA로 교체되지 않아 50-200 base pair(bp)가 단축된다. 만약 이 부분이 유전자 부분이라면 그 유전자는 사라지기 때문에 유전적 질환이 유발될 수 밖에 없다. 이를 예방하기 위해 모든 염색체 양쪽 말단에는 단백질 합성을 위한 RNA 전사 기능이 없고 특정 서열의 DNA 구조가 반복되는 텔로미어가 존재한다. 따라서 텔로미어는 세포분열 시 DNA 단축에 의한 유전자를 보호하는 기능하기 위해 존재한다. 텔로미어 단축은 DNA 복제 시 5'에서 3' 방향으로만 반 보존적(semiconservative)으로 발생하는 복제 기작으로 DNA의 지연 가닥을 완벽하게 복제할 수 없는 말단복제문제(end replication problem)에 기인한다. DNA 복제 기구의 세포 생학적 한계로 인해 지연가닥의 말단을 끝까지 복제할 수 없게 되고, 따라서 세포분열 시 <그림-1>의 B)처럼 말단 서열은 점차 단축된다. 이를 “end-replication problem”이라고 한다.
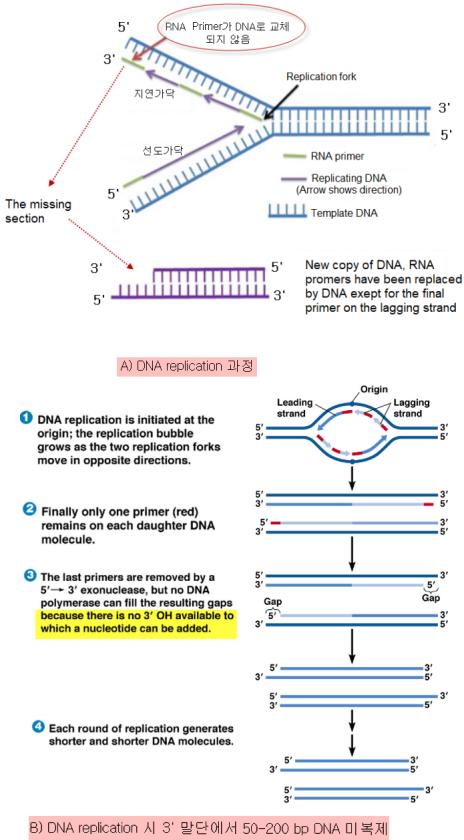
<그림-1> 텔로미어 단축의 기전-3 ´말단복제문제(end replication problem)
② 말단복제문제(end replication problem)의 원인인 5‘ 말단: DNA 합성과정에서 DNA 중합효소는 새로 합성되는 말단 뉴클레오티드의 3'-OH기에 디옥시리보오스에 결합되어 있는 5'-PO 4 기를 결합시켜 3', 5'-Phosphodiester linkage(인산 에스테르 결합)을 촉매한다. 선도가닥에서는 항상 뉴클레오티드의 3'-OH기가 존재하여 염색체 말단까지 합성이 가능한다. 반면에 지연가닥에서는 3'-OH기가 아닌 5'-PO 4 기가 염색체 말단에 끝나기 때문에 DNA polymerase가 RNA primer를 DNA로 대체할 수 없다. 즉, 마지막 RNA 프라이머에 DNA가 달라붙은 이후 RNA 프라이머를 제거하게 되면, 그 자리에 DNA가 붙는 데 필요한 3'-OH기가 없기 때문이다. <그림-2>는 선도가닥의 5`→3` 인산 에스테르 결합으로 연속적으로 DNA 합성이 이루어진다. 그러나 지연가닥에서는 3’말단이 아닌 5’말단이 존재하여 DNA polymerase에 의한 3', 5'-Phosphodiester linkage(인산 에스테르 결합)이 불가능하여 세포분열 마다 텔로미어에서 50-200 bp가 단축하게 된다.
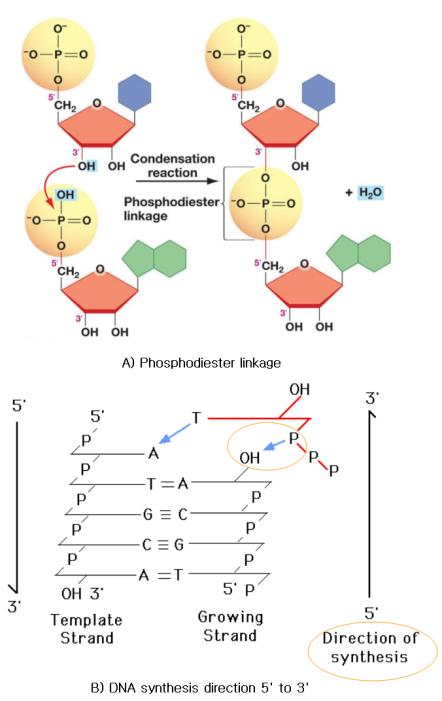
<그림-2> DNA 합성 방향: 5´→ 3´방향
3. 텔로미어-의존성 세네센스(telomere-dependent senscence)의 기전
○ 앞서 언급하였듯이 일반적으로 복제 세네센스는 세포분열시 발생하는 텔로미어 단축에 의해 발생하는 텔로미어-의존성 세네센스(telomere-dependent senescence)를 의미한다.
① 세포주기 조절과 DNA 손상: 유전독성물질과 같은 외부적 요인에 의한 세포주기의 조절에 가장 큰 영향을 주는 것은 DNA 손상이다. 이와 같은 DNA 손상에 이해 세포에서의 반응을 DNA damage response(DNA-손상 반응, DDR)이라고 한다. DDR의 주요 4대 반응으로는 DNA 손상 수선, 세포주기 조절(cell cycle regulation), 세포의 비가역적 복제 중지를 유도하는 복제 세네센스(replicative senescence) 현상 그리고 아파토시스(apoptisis) 등이 있다. 그러나 최근에는 주요 4대 반응보다 더 광범위한 반응을 나타내는데 특히 <그림-4>에서처럼 RNA 스프라이싱(RNA splicing), 세포의 자율리듬(circadian rhythm), 방추사 점검(mitotic spindle checkpoint), 유전자 발현을 위한 염색질의 기능적 구조에 대한 리모델링(chromatin remodeling), 방추사가 붙은 동원체를 구성하는 단백질(kinetochore proteins), 인슐린분비 신호체계(insulin signaling), 발암억제단백질(tumor suppressors), 전사조절인자(transcription), RNA 안정성(RNA stability), p53의 활성과 관련된 ubiquitine ligese 활성 등이 또 다른 중요한 DDR로 확인되고 있다. 또한 이러한 DDR을 통해 세포는 세포 자체에 가해지는 유전독성-스트레스(genotoxic stress)의 감소를 유도하게 된다. 그러나 유전독성-스트레스에 대한 DNA 수선 등을 비롯한 적절한 반응이 수행되지 못할 경우에는 유전자 불안정성이 증가되며 이는 곧 유전질환, 노화를 비롯한 암 등의 원인이 된다.
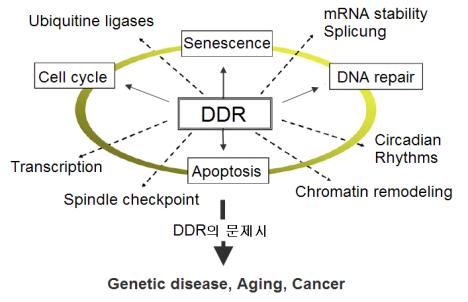
<그림-4> DNA damage response(DDR)의 세포 생화학적 및 생리학적 결과: DNA 손상에 의한 DDR은 신호전달체계를 통해 다양한 반응이 유도되며 이들은 곧 유전독성에 의한 스트레스를 감시킨다. 그러나 DDR의 문제가 있는 경우에는 DDR의 주요 4대반응인 세포주기 조절, DNA 수선과 아포토시스(apoptosis) 등의 수행에 문제가 발생하게 되며 유전질환, 노화 그리고 암 등이 발생된다. 최근 DDR의 주요 4대 반응에 외에 유전독성에 대해 다양한 DDR(점선)이 확인되고 있다.
② 텔로미어 말단의 T-loop과 Shelterin의 중요성: 사람의 텔로미어는 TTAGGG라는 6개의 Nucleotide가 1,000번 이상 반복 배열된 형태로 약 9 - 15 킬로베이스(K bp, Kilo base pair)이다. TTAGGG 반복 서열은 최종 말단인 염색체 말단에는 <그림-5>에서처럼 T-loop가 존재한다. 이는 nucleotide-protein complex로 염색체의 유전자를 보호하는 핵심적인 기능을 한다. T-loop의 nucleotide-protein complex에서 단백질 복합체(protein complex)를 셀테린(shelterin)이라고 한다. Shelterin은 telomere repeat binding factor 1(TRF1)과 TRF2 등의 단백질이 존재한다. 또한 텔로미어에서는 비번역 RNA가 전사되는데 이를 telomeric repeat-containing RNA (TERRA)라고 한다. T-loop의 nucleotide-protein complex와 shelterin의 가장 중요한 역할은 염색체 말단이 이중나선절단(double strand break, DSB)와 같은 DNA 손상으로 인식되어 DDR이 유도되는 것을 방지하는 것이다. 이는 텔로미어에 의한 염색체 전체의 염색체 안정성(chromosomeal stability)을 유지하게 된다.
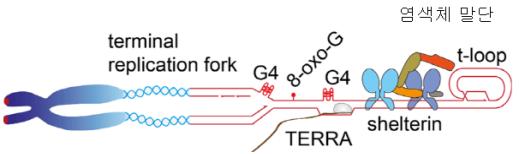
<그림-5> 염색체 말단에서 T-loop의 nucleotide-protein complex
③ DNA damage response(DNA-손상 반응, DDR)에 의한 세포주기에 대한 영향 기전: DNA 손상에 의한 DDR 수행을 위한 대표적인 감지자(sensor)는 탈인산화효소(kinase)인 ATM(ataxia-telangietasia, mutated)과 ATR(ATM and Rad3-related) 등이 있다. DNA 손상에 의해 이들 두 효소를 통한 세포의 DDR의 수행되는 기전을 “ATM/ATR regulation”이라고 한다. 특히 ATM은 화학물질 및 ionizing radiation에 의해 유도된 double-strand break, 반면에 ATR은 single-strand break의 DNA 손상을 각각 감지한다. <그림-6>에서처럼 DNA 손상에 의해 활성화된 ATM과 ATR은 p53의 인산화를 통한 직접적인 상호작용을 통하거나 ATM과 같이 다른 탈인화효소 Chk1(cell cycle checkpoint kinase 1) 그리고 Chk2(cell cycle checkpoint kinase 2)를 통하여 p53 활성화를 유도한다. 발암억제단백질인 p53 활 성화는 세포주기의 정지(cell cycle arrest)를 비롯하여 아포토시스(apoptosis) 등의 DDR이 수행된다.
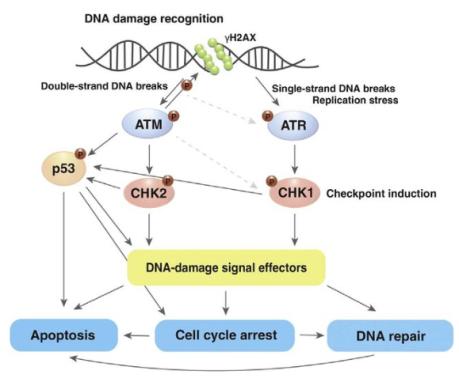
<그림-6> DNA 손상에 의한 DDR( DNA damage response) 기전과 세포 영향
④ 텔로미어의 이중나선절단과 DNA damage response에 의한 cellular senescence: 텔로미어의 DNA 합성은 DNA 말단 쪽으로 replication fork( 복제분기점) 에서 DNA 복제가 이루어진다. 그러나 텔로미어 말단에서의 최종적인 fork(terminal fork)에서 telomeric repeat( TTAGGG)는 복제를 위해 복제분기점에서 작동하는 모든 단백질의 조합인 replisome에 따라 복제되지 않는 경향이 있다. 이러한 결과로 <그림-7>의 A)에서처럼 4개의 염기 G가 모인 G-quadruplex(G4)의 DNA 4중 나선구조, 변형된 telomeric repeat-containing RNA (TERRA) 및 T-loop가 형성된다. 이와 같은 결과로 <그림-7>의 B)텔로미어에서 double strand break이 발생하고 DDR에 의한 세포주기의 중지와 더불어 replicative senescence가 발생하게 된다.
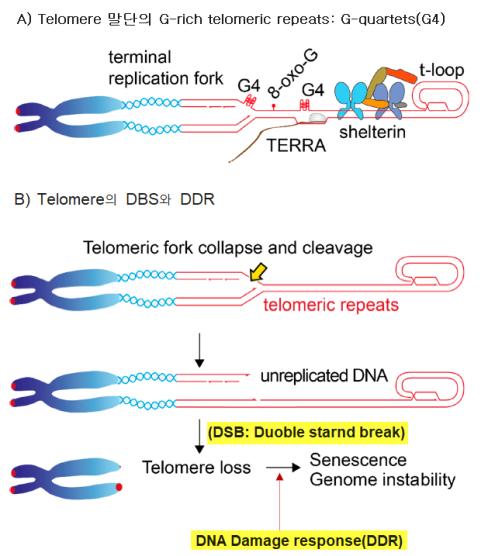
<그림-7> G-quadruplex(G4) 형성에 의한 double strand break과 DNA damage response에 의한 replicative senescence( Doksan, 2019)i
4. 텔로미어-의존성 세네센스(telomere-dependent senscence) 요약
○ 복제 세네센스의 유발 기전 측면에서 보면 발암유전자-유도성, ROS-유도성와 텔로미어-의존성 세네센스로 구분된다. 그러나 이들 모두 DDR(DNA damage response)을 통해 유도되어 p53-의존성 세네센스로 이해되고 있다. 대부분의 암환자에서 약 50% 이상에서 발암억제유전자인 p53 유전자의 돌연변이가 확인되는 것은 세포의 복제 중지 능력을 상실하기 때문이다.
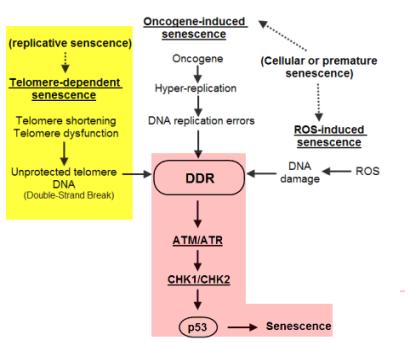
<그림-8> 다양한 세네센스 기전
